
题目列表(包括答案和解析)
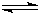 2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为
2SO3,如果2min内SO2的浓度由6mol/L下降为2mol/L,那么,用SO2浓度变化来表示的化学反应速率为(9分)对于下列反应:2SO2 + O2 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ 。
(4分)对于下列反应:2SO2 + O2  2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
2SO3,如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________ mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
(4分)对于下列反应:2SO2
+ O2 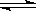 2SO3
, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________
mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
2SO3
, 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为________
mol/(L·min),如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ mol/L。
(9分)对于下列反应:2SO2 + O2
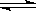 2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ 。
2SO3 , 如果2min内SO2的浓度由6 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____________,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_______ 。
2008.10
一、选择题(1---10题每空2分,11―20题每空3分;共50分)
1
2
3
4
5
6
7
8
9
10
B
A
A
D
C
B
B
A
D
C
11
12
13
14
15
16
17
18
19
20
B
D
A
A
B
D
D
A
C
C
二.填空题 (21题9分,22题9分。共18分)
21. (每空3分,共9分)
(1)N2H4(l)+2H2O2(l)=N2(g) +4H2O(g) △H=-644.25 KJ/mol
(2)410.125
(3)产物不会造成环境污染。
22. (每空2-3分 共9分)
(1) ;(3分)
;(3分)
(2)吸热; (2分)
(3)b、c; (2分)
(4)830 (2分)
三.实验题和推断题(23题12 分,24题 9分, 共21分)
23.(每问2分,共12分)
(1)环形玻璃搅拌棒 (2分)
(2)减少实验过程中的热量损失 (2分)
(3)偏小 (2分)
(4)不相等;相等; (4分)
(5)偏小 (2分)
24.(每空3分 共9分)
(1)2Al + 6H+ = 2Al3+ + 3H2↑ (3分)
(2)反应放出热量,温度升高,使化学反应速率加快(3分)
(3)(说明:可能存在多种假设,但只要假设合理均可)Cl-能够促进金属铝与H+反应;SO42- 对H+与金属铝的反应起阻碍作用。(3分)
【解析】氢离子浓度和铝片均相同,造成的差异应该与反应
(即2Al + 6H+ = 2Al3+ + 3H2↑)所处环境的不同(Cl- 和SO42-)有关。
四.计算题 (12分)
25.(每空2分,共6分)
2mol/(L?min);
1mol/(L?min);
2mol/L
26.(6分)
⑴x=4
⑵ >
⑶ C
(第四问选做)
(每空3分,共6分)
(4) a/4;
2.4+
(解析)
由已知得 消耗B=0.2mol 生成C 0.4mol/L*
所以x=4
由于此反应方程式前后系数和相等,则压强变化对平衡不起作用,所以只需把所有物质化到一边,使物质的量成比例即可。原平衡前为A:B=3:2,题中加入amolC,就是
原平衡时A,B,C的摩尔比为2.4:1.8:0.8,新平衡也满足这个比例
x/(a-4x/3)=3 所以x=
所以n(A)=(2.4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com