
题目列表(包括答案和解析)
反应3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
Fe3O4(s)+4H2(g)在温度和容积不变的条件下进行。下列叙述能表明反应达到平衡状态的是
| A.容器内压强不再改变 | B.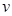 (H2O)= (H2O)=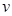 (H2) (H2) |
| C.气体的密度不再改变 | D.反应不再进行 |
A.K=
| ||
B.K=
| ||
C.K=
| ||
D.K=
|
题号
1
2
3
4
5
6
7
8
答案
A
D
B
C
C
A
C
C
题号
9
10
11
12
13
14
15
答案
D
B
D
D
D
A
B
16.⑴ 2,4 ⑵相等,0.6 ⑶① n(D)>4/3 mol ② n(C)=3.6mol n(D) >17/15mol
⑷8∶5
17.10-14;10-12;1:9;pH(酸)+pH(碱)=13
18.⑴ 2FeSO4?7H2O Fe2O3+SO2↑+SO3↑+14H2O
Fe2O3+SO2↑+SO3↑+14H2O
|