
题目列表(包括答案和解析)
将0.15 mol的MnO2与过量的12 mol·L-1的浓盐酸反应,和50 mL 12 mol·L-1的浓盐酸与足量的MnO2反应两者产生的Cl2相比(其他反应条件相同)?
A.一样多? B.前者较后者多?
C.后者较前者多? D.无法比较?
将0.15 mol的MnO2和过量的12 mol/L的浓盐酸反应,与50 mL12 mol/L的浓盐酸和过
量MnO2反应,两者产生的氯气相比(其它反应条件相同):( )
A.一样多 B.前者比后者多 C.后者比前者多 D.无法比较
A.C2H6O B.C3H6O C.C3H6O2 D.C4H8O2
将0.1 mol的镁、铝混合物溶于100mL 2mol/L H2SO4溶液中,然后再滴加1 mol/L NaOH溶液至过量。请回答:
(1)写出与铝有关的离子方程式:
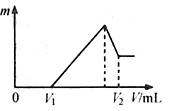
(2)若在滴加NaOH溶液过程中,沉淀质量m随加入NaOH溶液的体积V变化如图所示。当V1=160mL时,则金属粉末中n(Mg)= mol,
V2= mL。沉淀的最大质量是 g。
(3)若在滴加NaOH溶液过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)= mL。
(4)若混合物仍为0.1 mol,其中Mg粉的物质的量分数为a,用100 mL 2 mol/L的硫酸溶解此混合物后,再加入450 mL 1mol/L的NaOH溶液,所得沉淀中无Al(OH)3。满足此条件的a的取值范围是: 。
一、1.B 2.BD 3.D 4.BD 5.CD 6.B?
7.解析:浓盐酸与足量的MnO2反应时,随着反应的进行,盐酸浓度变小,后者反应会停止,有一部分HCl不能转变成Cl2。
答案:B?
8.D 9.B?
二、10.(1)先变红,后褪色?
(2)2FeCl2+Cl2===2FeCl3 溶液由浅绿色变棕黄色?
(3)AgNO3+HCl===AgCl↓+HNO3 产生白色沉淀?
(4)Na2CO3+2HCl===2NaCl+H2O+CO2↑ 产生无色无味的气体?
(5)SO2+Cl2+2H2O===H2SO4+2HCl 氯水褪色?
(6)Mg+2HCl===MgCl2+H2↑ 产生无色无味气体?
11.(1)KCl Al Al(OH)3?
(2)2KCl+2H2O 2KOH+Cl2↑+H2↑
2KOH+Cl2↑+H2↑
(3)Al3++3ClO-+3H2O===Al(OH)3↓+3HClO?
12.(1)水 (2)无水CaCl2?
(3)白磷上残留的水溶解在酒精中,残留的酒精又溶解在醚中?
(4)用NaOH溶液吸收(装置图略)?
13.(1)2 4 ―― 2 2 1 2 H2O?
(2)② (3)0.2 (4)2.63?
14.9.18 kg?
15.m(KClO3)为61.25 g,m(MnO2)为6.09 g;c(Na2SO3)为0.14 mol?L-1。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com