
题目列表(包括答案和解析)
将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol?L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g B. (m+6.8)g C.(m+2.55)g D.(m+12.0)g
已知下列热化学方程式:
(1)CH3COOH(l)+2O2(g) === 2CO2(g)+2H2O(l) △H1= -870.3 kJ?mol-1
(2)C(s)+O2(g) === CO2(g) △H2= -393.5 kJ?mol-1
(3)H2(g)+![]() O2(g) === H2O(l) △H3= -285.8 kJ?mol-1
O2(g) === H2O(l) △H3= -285.8 kJ?mol-1
则反应2C(s)+2H2(g)+O2(g)===CH3COOH(l) 的△H为( )kJ?mol-1
A.+488.3 B.-244.15 C.-488.3 D. +244.15
(08长沙雅礼中学一模)(16分)某课外实验小组学生利用下图所示装置进行“乙二酸(俗名草酸)晶体受热分解”的实验,并验证分解产物中有CO2和CO。(图中夹持装置已略去)
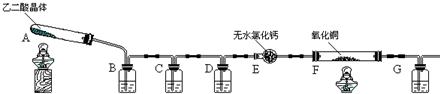 |
(1)装置C中盛放 溶液;D的作用是 ;
(2)证明分解产物中有CO的现象是 ;
(3)该装置有一个不足之处,请写出 ;
(4)某同学查阅相关资料:草酸是二元酸,酸性比碳酸强,在受热分解过程中有少量升华;草酸钙和草酸氢钙均为白色不溶物。因此该同学认为:需要在装置B之前增加一个装有________(填写下列编号字母)的洗气装置。
a.水 b.NaOH 溶液 c.Na2CO3 溶液 d.饱和NaHCO3 溶液
(5)草酸可以在酸性条件下被KMnO4氧化,反应的离子方程式为:
2MnO4- + 5H2C2O4 +6 H+ = 2Mn2+ +10 CO2↑+8 H2O
实验室常用草酸钠标定KMnO4溶液。操作如下:准确称取2.680 g草酸钠,放入锥形瓶中,加100 mL稀硫酸溶解,将锥形瓶置于 (填“酸式” “碱式”)滴定管下,用KMnO4溶液滴定。当 时,即达到滴定终点。重复上述滴定操作三次,实验数据如下表所示。
| 滴定前 | 第一次终点 | 第二次终点 | 第三次终点 | 第四次终点 |
滴定管 液面刻度 | 0.00 mL | 20.02 mL | 21.00mL | 19.98 mL | 20.00mL |
KMnO4溶液的物质的量浓度的是c(KMnO4)= mol?L-1。

 2A(g) △H =-92.4 kJ?mol―1
2A(g) △H =-92.4 kJ?mol―1 | 时间 | 浓度(mol/L) | ||
| c(W2) | c(B) | c(A) | |
| 第0 min | 4.0 | 9.0 | 0 |
| 第10min | 3.8 | 8.4 | 0.4 |
| 第20min | 3.4 | 7.2 | 1.2 |
| 第30min | 3.4 | 7.2 | 1.2 |
| 第40min | 3.6 | 7.8 | 0.8 |
 2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。
2NH3(g),若在恒温、恒压条件下向平衡体系中通入氩气,则平衡 移动(填“向左”“向右”或“不”);使用催化剂,上述反应的△H________(填“增大” “减小” 或“不改变”)。 式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。
式),生成该沉淀的离子方程式为____________。已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Cu(OH)2]=2.2×10-20。 中性,则Va︰Vb= 。
中性,则Va︰Vb= 。

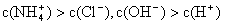

 NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)
NH3·H2O + H+,则该反应常温下的平衡常数K= (已知:常温下,NH3·H2O的电离平衡常数Kb=1.7×10—5 mol·L—1)一、1.BD 2.B 3.D 4.A 5.B 6.AC 7.D 8.AC 9.B?
10.解析:SO2 + 2NaOH===Na2SO3+H2O?
3 mol 6 mol 3 mol?
SO2 + NaOH===NaHSO3?
5 mol 5 mol 5 mol?
故n(SO2)∶n(NaOH)=(3+5)mol∶(6+5)mol=8∶11。?
答案:C
二、11.(1)②③⑤
(2)④
(3)①⑦⑧
(4)②⑤⑦⑧
(5)①
(6)⑥?
12.(1)氯气 二氧化硫?
(2)Cl2+2H2O+SO2===4H++2Cl-+SO
Ag++Cl-===AgCl↓
Ba2++SO ===BaSO4↓?
===BaSO4↓?
13.(1)a h i b c f g d?
(2)作用是使浓硫酸能顺利地滴入烧瓶中;原理是维持烧瓶内压强与分液漏斗内压强相等
(3)先加热V2O5,后缓缓滴入浓硫酸?
(4)有无色(或白色)晶体(或固体)生成?
(5)减小
(6) ×100%或
×100%或 ×100%
×100%
14.(1) (2)
(2) (3)
(3) <b<
<b<
15.(1)4 (2)
16.(1)a= (2)a=
(2)a= (3)
(3)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com