
题目列表(包括答案和解析)
(1)恒温、恒体积时在平衡状态的基础上按平衡状态的量再加入1倍的N2、H2、NH3,平衡怎样移动?新旧平衡状态相比较,NH3的质量分数是增大还是减小?
(2)恒温、恒体积时充入N2,平衡怎样移动?新旧平衡状态相比较,H2的质量分数是增大还是减小?
(3)恒温、恒体积时充入Ar,平衡怎样移动?新旧平衡状态相比较,NH3的质量分数是增大还是减小?
(4)恒温、恒压时充入Ar,平衡怎样移动?新旧平衡状态相比较,NH3的质量分数是增大还是减小?
温度/℃ | 550 | 650 | 750 | 850 | 897 |
压强/Pa | 5.32×101 | 9.17×102 | 3.87×103 | 495×104 | 1.01×105 |
按要求填空:
(1)若升高原CaCO3分解平衡体系的温度,同时给反应容器加压,则平衡____________。
A.向左移动 B.向右移动
C.不移动 D.无法确定平衡移动方向
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850 ℃建立了分解平衡。若将该容器的容积扩大为原来的2倍,当重新达到平衡时,容器内的温度将____________,CO2的平衡压强将____________4.97×104 Pa,理由是__________________。
温度/℃ | 550 | 650 | 750 | 850 | 897 |
压强/Pa | 5.32×10 | 9.17×102 | 8.37×103 | 4.94×104 | 1.01×105 |
按要求填空。
(1)若升高CaCO3分解平衡体系温度,同时缩小反应容器体积,则平衡_________(填代号)。
A.向左移动 B.向右移动
C.不移动 D.无法确定平衡移动的方向
(2)在一个与外界不能进行热交换的密闭容器中,足量的CaCO3在850 ℃时建立了分解平衡,若将容器扩大为原来的2倍,当重新达到平衡时,容器内的温度将_______(填“升高”“降低”“不变”“无法确定”),平衡时容器内的压强将_______(填“大于”“等于”“小于”“无法确定”)4.94×104 Pa,理由是 _________________________________________________。
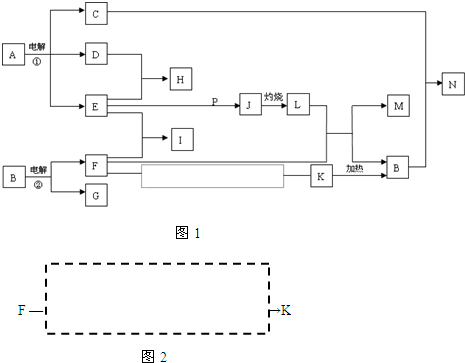
反应①②是重要的化工反应,D、E、F、G、M为单质,D、E、G、H为气体,且只有E为有色气体,G是空气中主要成分之一,F、M是生活中常见的金属,K是白色沉淀,C的焰色反应为黄色,P是M和紫黑色固体单质化合的产物,P、J、L、M含有同种元素,其物质间转化关系如下,虚框内是需设计的内容,反应物只能用A~N中的物质。请回答下列问题:

(1)用电子式表示H物质的形成过程
(2)电解池①中的阴极产物的名称
(3)足量的E与P溶液反应生成J,离子方程式为
(4)N溶液呈碱性,用离子方程式解释原因
(5)请模仿上述物质转化关系图设计F→K的最佳途径:(用A~N中的物质的化学式表示)
 |
F — →K
按设计得到1molK,至少需要另加的试剂及其物质的量是
n( )= mol;n( )= mol。
例6.从某些性质看,NH3与H2O相当,NH4+与H3O+,NH2―与O2―都有相当关系,下列有关方程式不正确的是 ( )
A. NH4Cl+KNH2=KCl+2NH3↑
B. M+2NH3=M(NH2)2+H2↑(M为二价活泼金属)
C. 2NH4Cl+MNH=MCl2+NH3
D. 2NH4Cl+MO=M(NH2)2+2HCl+H2O
解析:A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中MNH可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则有反应2NH4Cl+MO=MCl2+NH3↑+H2O
4.实战演练
一、 选择题:
1、下列有关硝酸化学性质的叙述中正确的是( )
A、浓、稀硝酸都能使蓝色石蕊试剂变红
B、硝酸(过量)能与Na2SO3反应,但不生成SO2
C、稀硝酸可与Na2S反应制得H2S
D、在碘化钾淀粉溶液中滴加稀硝酸溶液呈蓝色
2、污染环境的有害气体中,主要由于跟血红蛋白作用而引起中毒的有毒气体是( )
A、SO2
B、CO
3、某二价金属跟硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则反应中唯
一的还原产物可能是( )
A、NH3 B、N2O C、NO D、NO2
4、可不用棕色瓶存放,但必须用玻璃塞试剂瓶存放的药品是( )
A、氯水 B、硝酸银溶液 C、液溴 D、烧碱
5、Cu粉放A稀H2SO4中,加热后也无现象,当加入一种盐后,Cu粉质量减少,而
溶液变蓝,同时有气体生成,此盐是( )
A、氯化物 B、硫酸盐
C、硝酸盐 D、磷酸盐
6、下列酸的酸酐难以由单质间直接化合生成的有( )
A、H2CO3
B、HNO
7、下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
A、Fe2O3+HNO3 B、Al (OH)3+HNO3
C、C+HNO3(浓) D、Cu+HNO3
8、当三份Cu粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应后,收集到的气体在
相同状况下体积相等时,三份Cu粉的质量比为(不考虑NO2转化成N2O4和反应生成气体的溶解)
A、3:1:2 B、3:2:
9、下列关于浓硝酸和浓硫酸的叙述,正确的是( )
A、常温下都能用铝容器贮存
B、常温下都能与铜较快反应
C、露置在空气中,容器内酸液的质量都减少
 D、露置在空气中,容器内酸液的浓度均降低
D、露置在空气中,容器内酸液的浓度均降低
10、按右图进行实验,试管内装有12mLNO,然后间歇而缓慢
地通入8mLO2。下面有关实验最终状态的描述正确的是( )
A、试管内气体呈棕红色 B、试管内气体为无色是NO
C、试管内气体为无色是O2 D、试管内液面高度上升
二、 填空:
11、工业上制硝酸时,为使50%的硝酸转变为96%以上的硝酸,可采取的描施是
_______________________________。
12、检验硝酸钠晶体中硝酸根离子的方法是_______________________________。
三、 推断
 13、A、B、C、D、E五种物质能按图示变化(反应条件略):
13、A、B、C、D、E五种物质能按图示变化(反应条件略):
①若A在通常状况下是固体,则A、B、C、D、E的化学式分别
为:A____, B____, C____, D____, E_____。
②若A在通常状况下是气体,则A、B、C、D、E的化学式分别是:A____, B____, C____, D____, E_____。
14、下图中的每方格表示有关的一种反应物或生成物,其中A和C 为无色气体。





 |
 +盐酸 A +Na O D +木炭
+盐酸 A +Na O D +木炭


 (I)
△
(I)
△


 |


 |

 +NaOH C +D E +Cu
+NaOH C +D E +Cu△ 催化剂 △ (II)
填写下列空白:
①物质M可以是_____________,C是_________________,F是________________。
②反应(I)的化学方程是___________________________。
③反应(II)的离子方程是___________________________。
一、选择题:
1、BD 2、CD 3、B 4、C 5、C 6、BD 7、D 8、A 9、AD
10、BD
二、填空:
11、加入硝酸镁晶体或浓硫酸后进行蒸馏。
12、取少许晶体于洁净试管中加入适量浓硫酸后,插入一根螺旋状粗铜丝,如有红棕色
气体迅速产生,即证明晶体中有硝酸根离子。
三、推断
13、①S,H2S,SO2,SO3,H2SO4
②N2,NH3,NO,NO2,HNO3
14、①NH4HCO3或(NH4)2CO3,NH3,NO2
②2CO2+2Na2O2=2Na2CO3+O2
③3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com