
题目列表(包括答案和解析)
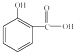 (1)食品和药品关系人的生存和健康.
(1)食品和药品关系人的生存和健康.

| ||
| ||
在氨的工业合成中,有三个关键的技术问题,请结合所学知识解决它们:
(1)合成氨的化学原理是N2+3H2 ![]() 2NH3,在工业上选择20―50MPa的较高压强和 500
2NH3,在工业上选择20―50MPa的较高压强和 500![]() 的温度来进行反应,请结合有关的化学原理解释。
的温度来进行反应,请结合有关的化学原理解释。
(2)在生产过程中需要大量氢气,现有以下几种获得氢气的方法,请你选出最适宜的,并说明理由。
A.电解水制取氢气;B.由煤或焦碳来制取氢气:煤或焦碳经加热,炽热的炭与水蒸气反应生成氢气;C.由天然气或重油制取氢气:天然气的主要成分甲烷在高温、催化剂的作用下与水蒸气反应生成氢气和一氧化碳,一氧化碳在催化剂存在的条件下与水蒸气反应得到氢气和二氧化碳。
(3)合成氨的生产工艺流程:首先用适当的方法生产出合成氨的原料气一一氮气和氢气。
氮气和氢气的混合气体在合成塔一定条件下,通过催化扭l的作用产生氨气,再通过氮分离器不断地把生成的氨分离出来,同时未转化的反应气体再进入合成塔循环加工。这就是合成氨的工艺流程。请根据这一描述过程画出流程方框图。

 N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1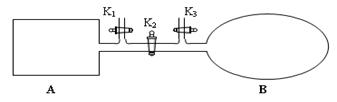
 N2O4已经达到平衡。
N2O4已经达到平衡。肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
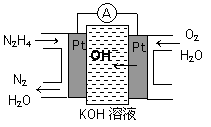
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:

N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g)![]() N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_ __。
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。

①B中可通过________________判断可逆反应2NO2![]() N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则 平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
肼(N2H4)又称联氨,广泛用于火箭推进剂、有机合成及燃料电池,NO2的二聚体N2O4则是火箭中常用氧化剂。试回答下列问题
(1)肼燃料电池原理如图所示,左边电极上发生的电极反应式为_________。
(2)火箭常用N2O4作氧化剂,肼作燃料,已知:
N2(g)+2O2(g)=2NO2(g) △H =-67.7kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H =-534.0kJ·mol-1
2NO2(g)![]() N2O4(g) △H =-52.7kJ·mol-1
N2O4(g) △H =-52.7kJ·mol-1
试写出气态肼在气态四氧化二氮中燃烧生成氮气和气态水的热化学方________。
(3)联氨的工业生产常用氨和次氯酸钠为原料获得,写出反应的离子方程式为_ __。
(4)如图所示,A是由易导热材料制成的体积不变的密闭容器,B是一耐化学腐蚀且易于传热的体积可变的透明气囊(体积改变过程中囊体弹力改变忽略不计)。关闭K2,将各1 mol NO2通过K1、K3分别充入A、B中,反应起始时A、B的体积相同均为a L。
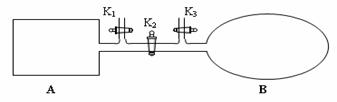
①B中可通过________________判断可逆反应2NO2![]() N2O4已经达到平衡。
N2O4已经达到平衡。
②若打开K2,平衡后B容器的体积缩至0.4a L,则打开K2之前,气球B体积为______L。
③若容器A中到达平衡所需时间t s,达到平衡后容器内压强为起始压强的0.8倍,则 平均化学反应速率v(NO2)等于____________________(用含a、t的代数式表示)。
④若平衡后在A容器中再充入0.5mol NO2,则重新到达平衡后,平衡混合气中NO2的体积分数_______________(填 “变大”“变小”或“不变”)。
例6.从某些性质看,NH3与H2O相当,NH4+与H3O+,NH2―与O2―都有相当关系,下列有关方程式不正确的是 ( )
A. NH4Cl+KNH2=KCl+2NH3↑
B. M+2NH3=M(NH2)2+H2↑(M为二价活泼金属)
C. 2NH4Cl+MNH=MCl2+NH3
D. 2NH4Cl+MO=M(NH2)2+2HCl+H2O
解析:A中KNH2可看成KOH,反应正确,B中NH3可看成H2O,反应正确,C中MNH可看成MO,反应同样也正确,而D中若将NH4Cl看成H3OCl即HCl,则有反应2NH4Cl+MO=MCl2+NH3↑+H2O
4.实战演练
一、 选择题:
1、下列有关硝酸化学性质的叙述中正确的是( )
A、浓、稀硝酸都能使蓝色石蕊试剂变红
B、硝酸(过量)能与Na2SO3反应,但不生成SO2
C、稀硝酸可与Na2S反应制得H2S
D、在碘化钾淀粉溶液中滴加稀硝酸溶液呈蓝色
2、污染环境的有害气体中,主要由于跟血红蛋白作用而引起中毒的有毒气体是( )
A、SO2
B、CO
3、某二价金属跟硝酸反应时,金属与硝酸所消耗的物质的量之比为2:5,则反应中唯
一的还原产物可能是( )
A、NH3 B、N2O C、NO D、NO2
4、可不用棕色瓶存放,但必须用玻璃塞试剂瓶存放的药品是( )
A、氯水 B、硝酸银溶液 C、液溴 D、烧碱
5、Cu粉放A稀H2SO4中,加热后也无现象,当加入一种盐后,Cu粉质量减少,而
溶液变蓝,同时有气体生成,此盐是( )
A、氯化物 B、硫酸盐
C、硝酸盐 D、磷酸盐
6、下列酸的酸酐难以由单质间直接化合生成的有( )
A、H2CO3
B、HNO
7、下列反应中,既能表现出硝酸的酸性,又能表现出其氧化性的是( )
A、Fe2O3+HNO3 B、Al (OH)3+HNO3
C、C+HNO3(浓) D、Cu+HNO3
8、当三份Cu粉分别与过量的稀硝酸、浓硝酸、热的浓硫酸反应后,收集到的气体在
相同状况下体积相等时,三份Cu粉的质量比为(不考虑NO2转化成N2O4和反应生成气体的溶解)
A、3:1:2 B、3:2:
9、下列关于浓硝酸和浓硫酸的叙述,正确的是( )
A、常温下都能用铝容器贮存
B、常温下都能与铜较快反应
C、露置在空气中,容器内酸液的质量都减少
 D、露置在空气中,容器内酸液的浓度均降低
D、露置在空气中,容器内酸液的浓度均降低
10、按右图进行实验,试管内装有12mLNO,然后间歇而缓慢
地通入8mLO2。下面有关实验最终状态的描述正确的是( )
A、试管内气体呈棕红色 B、试管内气体为无色是NO
C、试管内气体为无色是O2 D、试管内液面高度上升
二、 填空:
11、工业上制硝酸时,为使50%的硝酸转变为96%以上的硝酸,可采取的描施是
_______________________________。
12、检验硝酸钠晶体中硝酸根离子的方法是_______________________________。
三、 推断
 13、A、B、C、D、E五种物质能按图示变化(反应条件略):
13、A、B、C、D、E五种物质能按图示变化(反应条件略):
①若A在通常状况下是固体,则A、B、C、D、E的化学式分别
为:A____, B____, C____, D____, E_____。
②若A在通常状况下是气体,则A、B、C、D、E的化学式分别是:A____, B____, C____, D____, E_____。
14、下图中的每方格表示有关的一种反应物或生成物,其中A和C 为无色气体。





 |
 +盐酸 A +Na O D +木炭
+盐酸 A +Na O D +木炭


 (I)
△
(I)
△


 |


 |

 +NaOH C +D E +Cu
+NaOH C +D E +Cu△ 催化剂 △ (II)
填写下列空白:
①物质M可以是_____________,C是_________________,F是________________。
②反应(I)的化学方程是___________________________。
③反应(II)的离子方程是___________________________。
一、选择题:
1、BD 2、CD 3、B 4、C 5、C 6、BD 7、D 8、A 9、AD
10、BD
二、填空:
11、加入硝酸镁晶体或浓硫酸后进行蒸馏。
12、取少许晶体于洁净试管中加入适量浓硫酸后,插入一根螺旋状粗铜丝,如有红棕色
气体迅速产生,即证明晶体中有硝酸根离子。
三、推断
13、①S,H2S,SO2,SO3,H2SO4
②N2,NH3,NO,NO2,HNO3
14、①NH4HCO3或(NH4)2CO3,NH3,NO2
②2CO2+2Na2O2=2Na2CO3+O2
③3Cu+2NO3-+8H+=3Cu2++2NO↑+4H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com