
题目列表(包括答案和解析)
A.—定会有![]()
B.含有![]() 和Ag+
和Ag+
C.可能含有![]() 或Ag+或
或Ag+或![]() 或同时含有
或同时含有![]() 和
和![]()
D.可能含有![]() 或
或![]()
在某溶液中加入BaCl2溶液,生成白色沉淀,加入稀HNO3,沉淀不溶解,则下列关于该溶液所含离子的推断中正确的是( )
A.—定会有![]()
B.含有![]() 和Ag+
和Ag+
C.可能含有![]() 或Ag+或
或Ag+或![]() 或同时含有
或同时含有![]() 和
和![]()
D.可能含有![]() 或
或![]()

(18分)科学探究结果的准确性来自于探究活动中研究方法的科学性,研究过程的计划性、研究目的明确性。
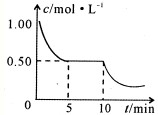
(一)学生(甲)应用下图装置(A)所示意的方法研究氯气的性质,其中气体的主要成分是氯气(含有空气和水蒸气)。请回答下列问题:
(1)该项研究(实验)的主要目的是
(2)浓硫酸的作用是 。与研究目的直接相关的实验现象是 ________________ _ 。
(3)虚框中的装置应选择 (填“B”或“C”),其盛放的试剂
为 (填试剂名称) ;使用该装置的目的是 ;该装置内发生反应的化学方程式为 。
(二)学生(乙)设计实验探究金属铝表面氧化膜的性质:将铝片(含氧化膜)投入浓氯化铜溶液中,铝表面很快出现一层海绵状暗红色物质。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。回答下列问题:
(1)铝片表面出现的暗红色物质的过程中发生的离子反应方程式是 。
(2)同学(乙)认为:铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因是“氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能”。并设计如下实验方案进行验证,请你根据其思路完成下列空格:
[实验方案] 在硫酸铜溶液中加入铝片,无明显现象,再加入 (填试剂名称),若反应明显加快了,说明上述推断正确。
1
2
3
4
5
6
7
8
AD
B
B
A
C
B
C
C
9
10
11
12
13
14
15
16
C
B
B
CD
D
A
C
BD
练习二
%20无机物的推断.files/image071.gif) 1、⑴ A、Na2SO3 B、BaCl2
1、⑴ A、Na2SO3 B、BaCl2
⑵ ①2Cl- + 2H2O 2OH- + Cl2↑ + H2↑
%20无机物的推断.files/image072.gif) ②BaSO3
+ Cl2 + H2O
BaSO4↓ +2H+ + 2Cl-
②BaSO3
+ Cl2 + H2O
BaSO4↓ +2H+ + 2Cl-
%20无机物的推断.files/image073.gif) ③SO2
+Cl2 + 2H2O
4H+ + 2Cl- + SO42-
③SO2
+Cl2 + 2H2O
4H+ + 2Cl- + SO42-
%20无机物的推断.files/image074.gif) 2、① CaC2 ② Ca2+
+CO32- CaCO3↓
2、① CaC2 ② Ca2+
+CO32- CaCO3↓
%20无机物的推断.files/image075.gif) ③ 2CO2
+ Ca(OH)2 Ca2+
+ 2HCO3-
③ 2CO2
+ Ca(OH)2 Ca2+
+ 2HCO3-
④ 5:1
3、① ClO- ② H+、Cl- ③ 4:5
%20无机物的推断.files/image076.gif) 4、①(NH4)2S O2 H2O
4、①(NH4)2S O2 H2O
② HNO3 NH4+ + OH- NH3↑ + H2O
%20无机物的推断.files/image074.gif) ③ H2SO4 S2- + 2H+ 2H2S↑
③ H2SO4 S2- + 2H+ 2H2S↑
5、① CO2、SO2、SO3、P2O5等中的任意两种
%20无机物的推断.files/image077.gif) S2- + 2H+ 2H2S↑
Al(OH)3 NaAlO2
S2- + 2H+ 2H2S↑
Al(OH)3 NaAlO2
② Y>X>Z 或 Z>X>Y
6、① NaOH ② NaAlO2 、 Ca(OH)2 ③ Mg(OH)2 ④CO2 ⑤Ca(HCO3)2
⑥Al(OH)3 ⑦ HCl
%20无机物的推断.files/image078.gif)
%20无机物的推断.files/image079.gif)
%20无机物的推断.files/image080.gif)
%20无机物的推断.files/image075.gif) 7、⑴① FeO + 2HCl FeCl2
+ H2O CuO + 2HCl CuCl2
+ H2O② 2FeO + C
7、⑴① FeO + 2HCl FeCl2
+ H2O CuO + 2HCl CuCl2
+ H2O② 2FeO + C %20无机物的推断.files/image081.gif) 2Fe
+ CO2
2CuO + C
Cu + CO2
2Fe
+ CO2
2CuO + C
Cu + CO2
%20无机物的推断.files/image082.gif)
%20无机物的推断.files/image083.gif) ③ Fe + CuCl2 FeCl2
+ Cu Fe +
2HCl
FeCl2 + H2↑
③ Fe + CuCl2 FeCl2
+ Cu Fe +
2HCl
FeCl2 + H2↑
⑵ m(x)=56g m(FeO):m(CuO)=9:5
%20无机物的推断.files/image085.gif)
%20无机物的推断.files/image086.gif)
%20无机物的推断.files/image074.gif) 8、① ② Na2SO3
+ H2SO4 Na2SO4
+ SO2↑ + H2O
8、① ② Na2SO3
+ H2SO4 Na2SO4
+ SO2↑ + H2O
③ 4FeS + 11O2 2Fe2O3 + 8SO2
④现在样品中加入足量的稀HCl,再加BaCl2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com