
题目列表(包括答案和解析)
 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol?L-1 | 5.00 | 3.52 | 2.48 |
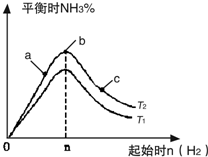 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产.请回答下列问题:| n |
| 3 |
| n |
| 3 |
(14分)实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1molCO2和 4molH2,一定条件下发生反应:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转化率w(H2)=_________________。
②该反应的平衡常数表达式K=____________。
③下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入1molCO2和4 molH2
(3)25℃,1.01×10 5Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:__________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有_____________;其正极的电极反应式是:_____________________。
(14分)实现 “节能减排” 和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g)CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为lL的密闭容器中,充入l mol CO2和4molH2,一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH) = ;H2的转化率w(H2) = 。
②该反应的平衡常数表达式K= 。
③下列措施中能使化学平衡向正反应方向移动的是 (填字母)。
A.升高温度
B.将CH3OH(g)及时液化抽出
C.选择高效催化剂
D.再充入l molCO2和4 molH2
(3)25℃,1.01×105Pa时,16g 液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:_____________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有__________ _;其正极的电极反应式是:______________。
(14分)实现“节能减排”和“低碳经济”的一项重要课题就是如何将CO2转化为可利用的资源。目前工业上有一种方法是用CO2来生产燃料甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
CH3OH(g)+H2O(g),下图1表示该反应过程中能量(单位为kJ·mol-1)的变化:
(1)关于该反应的下列说法中,正确的是____________(填字母)。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(2)为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和 4molH2,一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
CH3OH(g)+H2O(g),测得CO2和CH3OH(g)的浓度随时间变化如上图2所示。
①从反应开始到平衡,CH3OH的平均反应速率v(CH3OH)=___________;H2的转化率w(H2)=_________________。
②该反应的平衡常数表达式K=____________。
③下列措施中能使化学平衡向正反应方向移动的是___________(填字母)。
A.升高温度 B.将CH3OH(g)及时液化抽出
C.选择高效催化剂 D.再充入1molCO2和4 molH2
(3)25℃,1.01×10 5Pa时,16g液态甲醇完全燃烧,当恢复到原状态时,放出363.3kJ的热量,写出该反应的热化学方程式:__________________________。
(4)选用合适的合金为电极,以氢氧化钠、甲醇、水、氧气为原料,可以制成一种以甲醇为原料的燃料电池,此电池的负极应加入和通入的物质有_____________;其正极的电极反应式是:_____________________。
1
2
3
4
5
6
7
8
AD
B
B
A
C
B
C
C
9
10
11
12
13
14
15
16
C
B
B
CD
D
A
C
BD
练习二
%20无机物的推断.files/image071.gif) 1、⑴ A、Na2SO3 B、BaCl2
1、⑴ A、Na2SO3 B、BaCl2
⑵ ①2Cl- + 2H2O 2OH- + Cl2↑ + H2↑
%20无机物的推断.files/image072.gif) ②BaSO3
+ Cl2 + H2O
BaSO4↓ +2H+ + 2Cl-
②BaSO3
+ Cl2 + H2O
BaSO4↓ +2H+ + 2Cl-
%20无机物的推断.files/image073.gif) ③SO2
+Cl2 + 2H2O
4H+ + 2Cl- + SO42-
③SO2
+Cl2 + 2H2O
4H+ + 2Cl- + SO42-
%20无机物的推断.files/image074.gif) 2、① CaC2 ② Ca2+
+CO32- CaCO3↓
2、① CaC2 ② Ca2+
+CO32- CaCO3↓
%20无机物的推断.files/image075.gif) ③ 2CO2
+ Ca(OH)2 Ca2+
+ 2HCO3-
③ 2CO2
+ Ca(OH)2 Ca2+
+ 2HCO3-
④ 5:1
3、① ClO- ② H+、Cl- ③ 4:5
%20无机物的推断.files/image076.gif) 4、①(NH4)2S O2 H2O
4、①(NH4)2S O2 H2O
② HNO3 NH4+ + OH- NH3↑ + H2O
%20无机物的推断.files/image074.gif) ③ H2SO4 S2- + 2H+ 2H2S↑
③ H2SO4 S2- + 2H+ 2H2S↑
5、① CO2、SO2、SO3、P2O5等中的任意两种
%20无机物的推断.files/image077.gif) S2- + 2H+ 2H2S↑
Al(OH)3 NaAlO2
S2- + 2H+ 2H2S↑
Al(OH)3 NaAlO2
② Y>X>Z 或 Z>X>Y
6、① NaOH ② NaAlO2 、 Ca(OH)2 ③ Mg(OH)2 ④CO2 ⑤Ca(HCO3)2
⑥Al(OH)3 ⑦ HCl
%20无机物的推断.files/image078.gif)
%20无机物的推断.files/image079.gif)
%20无机物的推断.files/image080.gif)
%20无机物的推断.files/image075.gif) 7、⑴① FeO + 2HCl FeCl2
+ H2O CuO + 2HCl CuCl2
+ H2O② 2FeO + C
7、⑴① FeO + 2HCl FeCl2
+ H2O CuO + 2HCl CuCl2
+ H2O② 2FeO + C %20无机物的推断.files/image081.gif) 2Fe
+ CO2
2CuO + C
Cu + CO2
2Fe
+ CO2
2CuO + C
Cu + CO2
%20无机物的推断.files/image082.gif)
%20无机物的推断.files/image083.gif) ③ Fe + CuCl2 FeCl2
+ Cu Fe +
2HCl
FeCl2 + H2↑
③ Fe + CuCl2 FeCl2
+ Cu Fe +
2HCl
FeCl2 + H2↑
⑵ m(x)=56g m(FeO):m(CuO)=9:5
%20无机物的推断.files/image085.gif)
%20无机物的推断.files/image086.gif)
%20无机物的推断.files/image074.gif) 8、① ② Na2SO3
+ H2SO4 Na2SO4
+ SO2↑ + H2O
8、① ② Na2SO3
+ H2SO4 Na2SO4
+ SO2↑ + H2O
③ 4FeS + 11O2 2Fe2O3 + 8SO2
④现在样品中加入足量的稀HCl,再加BaCl2。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com