
题目列表(包括答案和解析)
(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:

(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
(7分)短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
(1)T在周期表中的位置 __________,第六周期与R同主族元素的原子序数为 ,该元素为 元素(填“金属”或“非金属”)
(2)元素的非金属性(原子得电子的能力):Q________T(填“强于”或“弱于”)。
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是气体,反应的化学方程式为______________________________________________。
(4)R有多种氧化物,其中甲的相对分子质量最小。在一定条件下,2 L的甲气体与0.5 L的氧气相混合,若该混合气体被足量的NaOH溶液完全吸收后没有气体残留,所生成的 R的含氧酸盐只有一种,则该含氧酸盐的化学式是____________。
【解析】根据元素在周期表中的位置可知T属于第三周期,T所处的周期序数与主族序数相等,所以T是Al,则Q是C,R是N,W是S。
(1)N是第ⅤA,所以第六周期、第ⅤA元素的原子序数是7+8+18+18+32=83,该元素是铅,属于金属元素。
(2)C是非金属,Al是金属,前者的非金属性强于后者。
(3)单质硫的化合价是0价,浓硫酸中硫的化合价是+6价,若二者反应的生成物只有2种,且一种是气体,因为生成物一定有水,则该气体只能是SO2。
(4)N的氧化物中相对分子质量最下的是NO。在反应中NO和O2的物质的量之比是4︰1,根据得失电子守恒可知NO的失去1个电子,化合价由+2价升高到+3价,因此含氧酸盐是NaNO2。
已知反应:mX(g)+ nY(g) qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
已知反应:mX(g)
+ nY(g)  qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
下列方法能使电离平衡H2O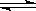 H++OH—向右移动,且使溶液呈酸性的是 ( )
H++OH—向右移动,且使溶液呈酸性的是 ( )
A、向水中加入少量硫酸氢钠固体 B、向水中加入少量硫酸铝固体
C、向水中加入少量碳酸钠固体 D、将水加热到100℃,使水的PH=6
【解析】考查外界条件对平衡的影响。由于水既能电离出氢离子,又能电离出OH-,所以不论是酸还是碱均能抑制水的电离,A不正确。盐类的水解可以促进水的电离,B中水解显酸性,C中水解显碱性,B正确,C错误。温度升高可以促进水的电离,但纯水在任何温度下都是显中性的。答案选B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com