
题目列表(包括答案和解析)
(8分)已知反应N2O4(g)==2NO2(g) △H=57.24kJ·mol-1 △S=176J·mol-1·K-1则在298.15K时该反应自发向 进行(填“左”或“右”),在500K时反应自发向 进行。
 2NH3(g);△H=-92.4kJ/mol现将1 molN2(g),3 mol H2(g)充入一容积为2L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分为ω,下列说法中正确的是
2NH3(g);△H=-92.4kJ/mol现将1 molN2(g),3 mol H2(g)充入一容积为2L的密闭容器中,在500 ℃下进行反应,10 min时达到平衡,NH3的体积分为ω,下列说法中正确的是 
| 高温、高压 |
| 催化剂 |
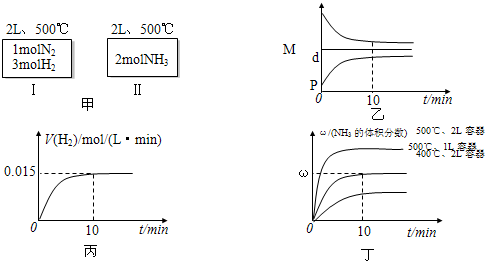
| A.如甲图所示:Ⅰ、Ⅱ两种途径中达到平衡时,NH3的体积分数均为ω,且Ⅰ中放出的热量与Ⅱ中吸收的热量之和为92.4kJ |
| B.反应进程中,混合气体的平均相对分子质量(M)、混合气体的密度(d)、混合气体的压强(P)三者的变化趋势如图乙所示 |
| C.若达到平衡时放出的热量为9.24kJ,则氢气的反应速度变化曲线如图丙所示 |
| D.若起始加入的物料均为1molN2、3molH2,在不同条件下达到平衡时,NH3的体积分数变化曲线如丁图所示 |
 2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )
2NH3(g);△H=-92.4kJ/mol现将1molN2和3molH2加入到2L的固定密闭容器中,在500℃下进行反应,10min达到平衡,NH3的体积分数为ω.下列说法正确的是( )
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com