
题目列表(包括答案和解析)
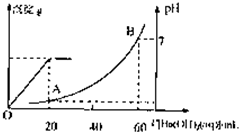 室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化).下列说法正确的是( )| A、图中A点溶液的pH=1 | B、生成沉淀的最大质量为2.33g | C、原混合溶液中盐酸物质的量浓度为0.1mol/L | D、当V[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO42-═BaSO4↓ |
室温时,盐酸和硫酸的混合溶液20mL,向混合物中逐滴加入0.05mol/L Ba(OH)2溶液时,生成的BaSO4和pH的变化如图所示(不考虑溶液混合时体积的变化)。下列说法正确的是
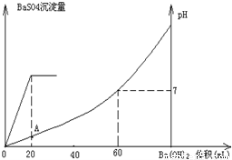
A.图中A点溶液的pH=1
B.生成沉淀的最大质量为2.33g
C.原混合溶液中盐酸物质的量浓度为0.1mol/L
D.当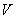 [Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO
[Ba(OH)2(aq)]=10mL时,发生反应的离子方程式为:Ba2++SO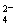 ═BaSO4↓
═BaSO4↓
(12分)今有①盐酸 ②硫酸 ③醋酸三种酸:
(1)在同体积,同PH的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(2)在同体积、同浓度的三种酸中,分别加入足量的锌粉,在相同条件下产生H2的体积由大到小的顺序是____________
(3)物质的量浓度为0.1 mol·L—1的三种酸溶液的PH由大到小的顺序是____________ _;如果取等体积的0.1 mol·L—1的三种酸溶液,用0.1 mol·L—1的NaOH溶液中和,当恰好完全反应时,消耗溶液的体积由大到小的顺序是____________ ___(以上均用酸的序号填写)。
一、1.解析:Fe Fe2+
Fe2+ Fe3+
Fe3+ Fe(OH)3
Fe(OH)3 Fe2O3。
Fe2O3。
答案:A?
2.B 3.C?
4.解析:根据2Fe3++Fe===3Fe2+知,消耗1 mol Fe生成3 mol Fe2+,还消耗2 mol Fe3+。
答案:C?
5.C 6.A 7.B 8.A 9.C 10.AD?
二、11.Fe2O3 CO和H2 Fe3O4、FeO?
12.(1)白色沉淀 灰绿色
灰绿色 红褐色沉淀?
红褐色沉淀?
(2)3Fe+2NO +8H+===3Fe2++2NO↑+4H2O?
+8H+===3Fe2++2NO↑+4H2O?
(3)由反应2HNO3+NO===3NO2+H2O知,在浓HNO3中不可能生成NO?
13.(1)Fe Cl2 H2?
(2)2Fe+3Cl2 2FeCl3
2FeCl3
(3)2HCl+Fe===FeCl2+H2↑?
(4)2FeCl2+Cl2===2FeCl3?
14.(1)Fe FeCl3 FeCl2 Fe(OH)3 Fe2O3 (2)略?
15.65 g 20.5%?
16.(1)ac?
(2)设Fe2O3原有n0 mol,还原百分率为A%,则有?


A%= ≈33.3%
≈33.3%
(3)3-
(4)Fe2O3、Fe3O4 8<a<9?
Fe3O4、FeO 6<a<8?
Fe2O3、Fe3O4、FeO 6<a<9
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com