
题目列表(包括答案和解析)
| 3 |
| 2 |
| 1 |
| 3 |
| 2 |
| 3 |
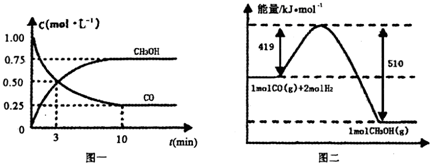
| 容器 | 反应物投入的量 | 反应物的转化率 | CH3OH的浓度 | 能量变化 (Q1,Q2,Q3均大于0) |
| 甲 | 1mol CO和2mol H2 | a1 | c1 | 放出Q1kJ热量 |
| 乙 | 1mol CH3OH | a2 | c2 | 吸收Q2kJ热量 |
| 丙 | 2mol CO和4mol H2 | a3 | c3 | 放出Q3kJ热量 |
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/°C | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
| 8 |
| 15 |
| 8 |
| 15 |
| 序号 | 不纯物 | 除杂试剂 | 分离方法 |
| A | CH4(C2H4) | 酸性KMnO4溶液 | 洗气 |
| B | Fe2O3(Al2O3) | NaOH溶液 | 过滤 |
| C | CO2(HCl) | NaOH溶液 | 洗气 |
| D | NaCl (Na2CO3) | 稀硫酸 | 蒸发结晶 |
| A、A | B、B | C、C | D、D |
一、1.B 2.D 3.D?
4.解析:FexOy+yCO xFe+yCO2?
xFe+yCO2?
(56x+16y) g y mol?
 mol
mol
得:x∶y=2∶3?
答案:B
5.AD 6.B 7.B 8.CD?
9.解析:A.如AlO B.如C+FeO
B.如C+FeO CO↑+Fe C.如Br-
CO↑+Fe C.如Br- Br2 D.如Fe3+
Br2 D.如Fe3+ Fe2+
Fe2+
答案:AD?
10.C?
二、11.FeCO3在空气中加热,因+2价铁被空气氧化而得不到FeO;而FeC2O4分解,产生的CO可作保护气,防止FeO氧化。?
12.(1)普通铁粉(或铁粉) 作为水蒸气发生器(或用来产生水蒸气) 防止水倒吸(或用作安全瓶) 氢气?
(2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂) 6摩/升HCl?
注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。?
(3)ABE (必须全对给一分,错、漏一个即不给分)?
(4)加快氢气产生的速度?
(5)Fe3O4+4H2 3Fe+4H2O?
3Fe+4H2O?
(6)检验氢气的纯度 点燃氢气?
13.(1)A.浓NaOH溶液 B.NH4Cl固体 C.碱石灰 X:NH3?
(2)NaOH+NH4Cl NaCl+NH3↑+H2O?
NaCl+NH3↑+H2O?
2NH3+3CuO 3Cu+N2↑+3H2O?
3Cu+N2↑+3H2O?
14.(1)20.4% (2)BaO?Fe2O3?
15.Cu2O和Cu w(Cu2O)=42.9% w(Cu)=57.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com