
题目列表(包括答案和解析)
(2013?泰安一模)下列陈述I、II均正确并且有因果关系的是( )
|

| c3(H+) |
| c(Fe3+) |
| c3(H+) |
| c(Fe3+) |
(16分)
(1)已知298K时,Fe(OH)3的溶度积常数 =2.6×10-39, Mg(OH)2的溶度积常数
=2.6×10-39, Mg(OH)2的溶度积常数 =5.6×
=5.6× ,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
,取适量浓度均为0.1mol/L的MgCl2和FeCl3混合液(含HCl),加入一定量的MgCO3达到沉淀溶液平衡,测得pH=4.00,则此温度下残留在溶液中的c(Fe3+)=______________;
有没有Mg(OH)2沉淀生成______________填“有”或“无”),理由是________________________________。
(2)酸HnA与碱B(OH)m完全反应生成正盐.
①若HnA为HCl,且该盐溶液的pH<7,用离子方程式说明原因:
②若将0.4mol·L-1的NaOH溶液与0.2mol·L-1的HnA溶液等体积混合后pH=10,
则HnA为 (填序号).
a.一元强酸 b. 一元弱酸 c. 二元强酸 d. 二元弱酸
(3)某学校课外兴趣小组从海水晒盐后的盐卤(主要含Na+、Mg2+、Cl-、Br-等)中模拟工业生产来提取镁,主要过程如下:回答下列问题:
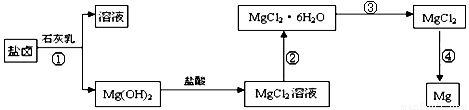
ⅰ.从过程①得到的Mg(OH)2沉淀中混有少量的Ca(OH)2 ,除去少量Ca(OH)2的方法是先将沉淀加入到盛有 溶液的烧杯中,充分搅拌后经过滤、洗涤可得纯净的Mg(OH)2。
ⅱ.过程③的转化需要在HCl气流中加热,HCl的作用是
ⅲ.写出过程④中发生反应的化学方程式
把SO2通入Fe(NO3)3溶液中,溶液由棕黄色变为浅绿色,但立即又变为棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀。上述一系列过程中,最终被还原的是
A.SO2 B.Cl- C.Fe3+ D.NO
(15分)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
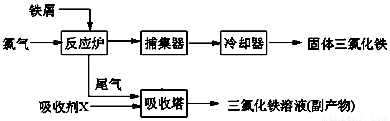
(1)试写出吸收塔中反应的离子方程式:____________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
|
温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
|
溶解度(g/100gH20) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是: 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为: 。
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)FeCl3的质量分数通常可用碘量法测定:称取m克无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c mol/L Na2S2O3溶液滴定用去V mL。
(已知:I2+2S2O32-=2I- +S4O62-)
①滴定终点的现象是:____________________________。
②样品中氯化铁的质量分数为: 。
③某同学根据上述方案,使用上述(2)中获得的FeCl3·6H2O样品代替无水氯化铁样品进行测定。通过计算发现产品中的质量分数大于100%,其原因可能是 。
一、1.B 2.D 3.D?
4.解析:FexOy+yCO xFe+yCO2?
xFe+yCO2?
(56x+16y) g y mol?
 mol
mol
得:x∶y=2∶3?
答案:B
5.AD 6.B 7.B 8.CD?
9.解析:A.如AlO B.如C+FeO
B.如C+FeO CO↑+Fe C.如Br-
CO↑+Fe C.如Br- Br2 D.如Fe3+
Br2 D.如Fe3+ Fe2+
Fe2+
答案:AD?
10.C?
二、11.FeCO3在空气中加热,因+2价铁被空气氧化而得不到FeO;而FeC2O4分解,产生的CO可作保护气,防止FeO氧化。?
12.(1)普通铁粉(或铁粉) 作为水蒸气发生器(或用来产生水蒸气) 防止水倒吸(或用作安全瓶) 氢气?
(2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂) 6摩/升HCl?
注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。?
(3)ABE (必须全对给一分,错、漏一个即不给分)?
(4)加快氢气产生的速度?
(5)Fe3O4+4H2 3Fe+4H2O?
3Fe+4H2O?
(6)检验氢气的纯度 点燃氢气?
13.(1)A.浓NaOH溶液 B.NH4Cl固体 C.碱石灰 X:NH3?
(2)NaOH+NH4Cl NaCl+NH3↑+H2O?
NaCl+NH3↑+H2O?
2NH3+3CuO 3Cu+N2↑+3H2O?
3Cu+N2↑+3H2O?
14.(1)20.4% (2)BaO?Fe2O3?
15.Cu2O和Cu w(Cu2O)=42.9% w(Cu)=57.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com