
题目列表(包括答案和解析)
我国的稀土矿含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为:
RE2(SO4)3+Na2SO4+xH2O ![]() RE2(SO4)3?Na2SO4?xH2O(x=1,2)
RE2(SO4)3?Na2SO4?xH2O(x=1,2)
下列有关叙述正确的是
A、该反应一定在强碱溶液中进行
B、产生沉淀的反应为复分解反应
C、反应生成的沉淀属于复盐
D、产生沉淀的变化属于物理变化
我国的稀土矿含量丰富,稀土元素可用RE表示。在提纯过程中可以向稀土元素的硫酸盐溶液中加入粉状Na2SO4,使稀土元素转化为沉淀,反应为;RE2(SO4)3+Na2SO4+xH2O![]() RE2(SO4)3·Na2SO4·xH2O(x=1,2),下列有关叙述正确的是
RE2(SO4)3·Na2SO4·xH2O(x=1,2),下列有关叙述正确的是
( )
A. 该反应一定在强碱溶液中进行
B. 产生沉淀的反应为复分解反应
C. 反应生成的沉淀属于复盐
D. 产生沉淀的变化属于化学变化
( )
A. 该反应一定在强碱溶液中进行
B. 产生沉淀的反应为复分解反应
C. 反应生成的沉淀属于复盐
D. 产生沉淀的变化属于化学变化


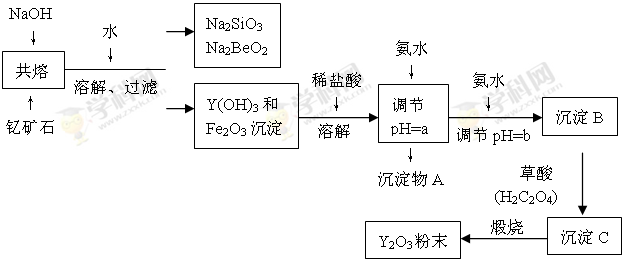
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 2.7 | 3.7 |
| Y3+ | 6.0 | 8.2 |
一、1.B 2.D 3.D?
4.解析:FexOy+yCO xFe+yCO2?
xFe+yCO2?
(56x+16y) g y mol?
 mol
mol
得:x∶y=2∶3?
答案:B
5.AD 6.B 7.B 8.CD?
9.解析:A.如AlO B.如C+FeO
B.如C+FeO CO↑+Fe C.如Br-
CO↑+Fe C.如Br- Br2 D.如Fe3+
Br2 D.如Fe3+ Fe2+
Fe2+
答案:AD?
10.C?
二、11.FeCO3在空气中加热,因+2价铁被空气氧化而得不到FeO;而FeC2O4分解,产生的CO可作保护气,防止FeO氧化。?
12.(1)普通铁粉(或铁粉) 作为水蒸气发生器(或用来产生水蒸气) 防止水倒吸(或用作安全瓶) 氢气?
(2)固体NaOH(或碱石灰、CaO等碱性固体干燥剂) 6摩/升HCl?
注:G中如填写酸性干燥剂或液体干燥剂,则此空不给分。?
(3)ABE (必须全对给一分,错、漏一个即不给分)?
(4)加快氢气产生的速度?
(5)Fe3O4+4H2 3Fe+4H2O?
3Fe+4H2O?
(6)检验氢气的纯度 点燃氢气?
13.(1)A.浓NaOH溶液 B.NH4Cl固体 C.碱石灰 X:NH3?
(2)NaOH+NH4Cl NaCl+NH3↑+H2O?
NaCl+NH3↑+H2O?
2NH3+3CuO 3Cu+N2↑+3H2O?
3Cu+N2↑+3H2O?
14.(1)20.4% (2)BaO?Fe2O3?
15.Cu2O和Cu w(Cu2O)=42.9% w(Cu)=57.1%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com