
题目列表(包括答案和解析)
T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) 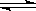 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________.
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”),原因是______________________________.
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________.
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________.
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________.
T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________.
(2)乙容器中反应达到平衡时所需时间t________4min(填“大于”、“小于”或“等于”),原因是______________________________.
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________.
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________.
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________.
T℃时,有甲、乙两个密闭容器,甲容器的体积为1 L,乙容器的体积为2 L,分别向甲、乙两容器中加入6 mol A和3 mol B,发生反应如下:3A(g)+bB(g) 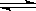 3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
3C(g)+2D(g) ΔH<0; 4 min时甲容器内的反应恰好达到平衡,A的浓度为2.4 mol/L,B的浓度为1.8 mol/L; t min时乙容器内的反应达平衡,B的浓度为0.8 mol/L.根据题给信息回答下列问题:
(1)甲容器中反应的平均速率v(B)=________,化学方程式中计量数b=________.
(2)乙容器中反应达到平衡时所需时间t________4 min(填“大于”、“小于”或“等于”),原因是______________________________.
(3)T℃时,在另一个体积与乙相同的丙容器中,为了达到平衡时B的浓度仍然为0.8 mol/L,起始时,向丙容器中加入C、D的物质的量分别为3 mol、2 mol,则还需加入A、B的物质的量分别是________、________.
(4)若要使甲、乙容器中B的平衡浓度相等,可以采取的措施是________.
A.保持温度不变,增大甲容器的体积至2 L
B.保持容器体积不变,使甲容器升高温度
C.保持容器压强和温度都不变,向甲中加入一定量的A气体
D.保持容器压强和温度都不变,向甲中加入一定量的B气体
(5)写出平衡常数表达式K=________,并计算在T℃时的化学平衡常数K=________.
一、1.D?
2.解析:Cl2被完全吸收,Cl2应在下部生成,推知b为正极,a为负极。?
答案:B?
3.C 4.CD 5.B 6.A 7.A 8.BD 9.A?
二、10.(1)Fe Fe-2e-===Fe2+ (2)BC?
(3)隔离空气,防止生成的Fe(OH)2被氧化 加热c,以除去溶解的O2?
(4)BC?
(5)白色沉淀迅速变成灰绿色,最后变成红褐色?
11.(1)有红色物质析出为负极 (2)铜导线变粗为负极?
12.(1)2Cl--2e-===Cl2↑ 升高?
(2)Ca2++CO ===CaCO3↓?
===CaCO3↓?
Mg2++2OH-===Mg(OH)2↓?
(3)AC (4)BC (5)蒸发 过滤?
(6)NaCl+H2O NaClO+H2↑(或2NaCl+2H2O
NaClO+H2↑(或2NaCl+2H2O 2NaOH+H2↑+Cl2↑?
2NaOH+H2↑+Cl2↑?
Cl2+2NaOH===NaCl+NaClO+H2O)?
13.(1)B (2)C?
(3)5KI+KIO3+6HCl===6KCl+3I2+3H2O 5∶1 溶液变蓝?
(4)阳极:I-+3H2O-6e-===IO-3+6H+?
阴极:6H2O+6e-===3H2↑+6OH-?
(5)0.837?
14.T介于
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com