
题目列表(包括答案和解析)

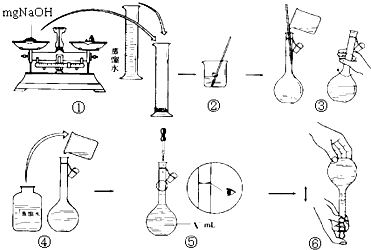
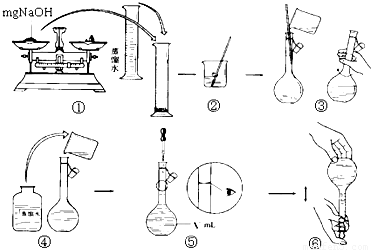
用质量分数为98%的浓硫酸(密度为1.84g/cm3)配制成1mol/L的稀硫酸.现实验室仅需要这种硫酸220mL.试回答下列问题:
(1)配制稀硫酸时,应选用容量为________mL的容量瓶;
(2)经计算需要用量筒量取________mL浓硫酸,在量取时宜选用下列量筒中的____(填字母).
A.5mL B.10mL C.15mL D.50mL
(3)在量取浓硫酸后,进行了下列操作:
①等稀释的硫酸其温度与室温一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸馏水至液面接近环形标线1-2cm处,改用胶头滴管加蒸馏水,使溶液的凹液面底部与瓶颈的环形标线相切。
③在盛硫酸的烧杯中注入蒸馏水少量,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶上述操作中,正确的顺序是(填序号)________。
(4)指出本实验操作错误的地方,并进行更正______________________________________
(5)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓硫酸,其配制的稀硫酸浓度会________(填“偏高”、“偏低”、“无影响”,下同).若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀硫酸浓度会________。
一、1.解析:设原溶液中水的质量为w g,R的质量为 m g,R的溶解度为S g,则有:

根据比例性质,可设:?

S= ×100=
×100=
答案:B?
2.解析:注意体积效应。?
答案:B?
3.解析:因H2SO4溶液的密度随浓度增大而增大,是一个变值而不是一个定值。设稀释后溶液密度为ρ′,则有:18× ×10-3=9×
×10-3=9× ×10-3,2
×10-3,2 =
= ,因为
,因为
ρ′<ρ,故V<100(mL)。
答案:A?
4.解析:NH3+2O2===HNO3+H2O?
HNO3%= ×100%=78%
×100%=78%
答案:A
5.AB 6.B 7.B 8.D 9.C?
二、10.
11.
 g
g
12.(1)G、E、C、H、F(或E、G、C、H、F)?
(2)BCD
14.(1)0.0813 mol?L-1 (2)32 mL?
15.(1)四种?
①KOH,K2CO3 ②K2CO3 ③K2CO3,KHCO3?④KHCO3?
(2)解:2KOH+CO2 === K2CO3+H2O?
22.4 138?
2.24 x=13.8?
KOH+CO2===KHCO3?
22.4 100?
2.24 x=10.0?
从上面两方程知:生成的固体全部是K2CO3时应该是 =0.100 mol
=0.100 mol
若K2CO3为a mol,则KHCO3为(0.100-a)mol?
则得方程
即K2CO3和KHCO3各为0.050 mol?
K2CO3为:
KHCO3为:
依K+守恒的要求,设KOH溶液浓度为c则:?
0.300 Lc=0.050 mol×2+0.050 mol c=0.50 mol?L-1
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com