
题目列表(包括答案和解析)
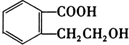
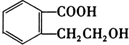



| 序号 | 元素 | 结构及性质 | ||
| ① | A | A的单质能与冷水剧烈反应,所得强碱性溶液中含有两种电子数相同的阴、阳离子 | ||
| ② | B | B原子最外层电子数是内层电子总数的
| ||
| ③ | C | C的氧化物是两性氧化物,且作为耐火材料 | ||
| ④ | D | A、D、E组成的36电子的化合物甲是家用消毒剂的主要成分 | ||
| ⑤ | E | 通常情况下,E没有正化合价,A、B、C、D、F都能与E形成化合物 | ||
| ⑥ | F | F元素最高正价与最低负价的代数和为4 |
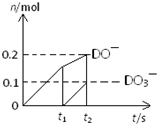
| 实验编号 | 温度/℃ | 加入试剂 | 加入Y的量 |
| ① | 5 | 2滴 1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ② | 40 | 2滴1mol/L FeCl3溶液 | 4mL 10% 的Y溶液 |
| ③ | 40 | 2滴1mol/L FeCl3溶液 2mL X |
(16分)
某化学小组拟采用如下装置(夹持和加热仪器已略去)来电解饱和食盐水,并用电解产生的H2还原CuO粉末来测定Cu的相对原子质量,同时验证氯气的氧化性。
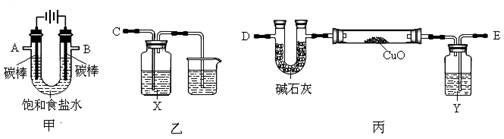
(1)写出甲中反应的化学方程式 。
(2)为完成上述实验,正确的连接顺序为A连______,B连______(填接口字母)。
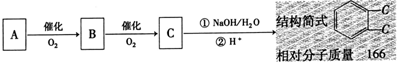
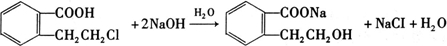
(3)乙装置中X试剂可以是 ,丙装置中Y试剂的作用是 。
(4)测定Cu的相对原子质量。
将w g CuO置于硬质玻璃管中,按以下两个方案测得的数据计算Cu的相对原子质量。
|
方案 质量[ |
方案一[来] |
方案二 |
|
U型管+固体 |
硬质玻璃管+固体 |
|
|
反应前质量/g |
a |
c |
|
完全反应后质量/g |
b |
d |
请你回答:
你认为方案 较佳,另一个方案得到的Cu的相对原子质量会 (填“偏低”、“偏高”)。按较佳方案计算,得到Cu的相对原子质量是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com