
题目列表(包括答案和解析)
近期,我国个别企业违法排污导致地下
水严重污染又成为媒体焦点。对水的质量监控
有很多指标,其中水中溶解氧(DO)的多少是衡量水体自净能力的一个指标。
I.对溶解氧(DO)的测定步骤是:
①在一定温度下量取100.00mL新鲜水样,在碱性条件下使其中的O2将Mn2+氧化为MnO(OH)2:
②向步骤①反应后的溶液中加入KI溶液,使其中生成的MnO(OH)2再还原成Mn2+:

③最后用0.0100 mol·L-1Na2S2O3标准溶液滴定步骤②中生成的I2: ,
,
消耗Na2S2O3标准溶液11.00mL。
(1)步骤③使用的指示剂是淀粉试液。滴定终点时指示剂的颜色变化情况是____。
(2)硫代硫酸(H2S2O3)是一种二元弱酸。步骤③应选用____滴定管进行滴定,结合离子方程式说明原因:________。
(3)水样中溶解氧(DO)的浓度为 mg·L-1。
II.该实验需用Na2S2O3固体配制100mL 0.0100 mol·L-1Na2S2O3标准溶液。
(4)请按配制的过程填写选用仪器的顺序:____ (填编号)。
①玻璃棒②胶头滴管③100mL容量瓶④天平⑤25mL烧杯
(5)配制0.0100mol·L-1Na2S2O3标准溶液时,下列操作使所配溶液浓度偏高的是____。
A.没有用蒸馏水洗涤烧杯
B.定容时俯视容量瓶刻度线
C.配制前容量瓶洗净后没干燥
D.摇匀后见液面下降,再加水至刻度线
E.用天平称量药品时,左盘低,右盘高
| 实验操作 | 预期现象和结论 |
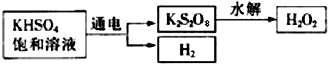
X、Y、Z、W四种主族元素分布在三个不同的短周期,它们的原子序数依次增大,其中Y与Z为同一周期,X与W为同一主族,Z元素的外围电子排布为nsnnp2n,W在空气中燃烧可以得到淡黄色固体。又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体。请回答下列问题:
(1)W在元素周期表中的位置是 ;基态时Y的电子排布式是___。
(2)比较元素Y和Z的第一电离能:Y Z(填“大于”、“小于”或“不确定”),将YX3通入溴水中可发生反应,生成Y的单质和一种盐M,Y的单质中的σ键和π键个数比为 ,盐M的晶体类型是 。
(3)由W和Y组成的化合物易水解,其水解的化学方程式是 ;
(4)已知Y2X4和过氧化氢混合可作火箭推进剂。12.8g液态Y2X4与足量过氧化氢反应生成Y的单质和气态水,放出256.65kJ的热量:
2H2O2(l) = O2(g)+2H2O(l) ΔH=-196.4KJ/mol
H2O(l) = H2O(g) ΔH=+44KJ/mol
写出液态Y2X4和氧气反应生成Y的单质和液态X2Z的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com