“氢”既是重要的化工原料,也是未来最理想的新能源.
(1)①实验测得,1g氢气燃烧生成液态水时放出142.9kJ热量,1mol H
2O(g)转变为1mol H
2O(l)时放出44.0kJ热量.则氢气燃烧生成H
2O(g)的热化学方程式为
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ?mol-1
.
②熔融碳酸盐燃料电池(MCFS)是使用熔融碳酸锂、碳酸钾作电解质的一种新型电池,该电池的工作温度为650℃.负极由镍铬铝合金烧结而成,正极材料为多孔镍,电池反应为:H
2+CO+O
2=CO
2+H
2O.下列说法不正确的是
AB
AB
A.负极反应Al-3e
-=Al
3+ B.燃料气体是氧气
C.正极反应为2CO
2+O
2+4e
-=2CO
32- D.该电池也可用烃类作燃料
(2)用CO
2和氢气为原料,在催化剂作用下发生如下反应,
2CO
2(g)+6H
2(g)
CH
3CH
2OH(g)+3H
2O(g) 25℃时,K=2.95ⅹ10
11①该反应的平衡常数表达式K=
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
| c(CH3CH2OH).C3(H2O) |
| C2(CO2).C6(H2) |
.
②在一定压强下,
=2,测得反应的实验数据如下表.
| 温度(K) |
500 |
600 |
700 |
800 |
| CO2转化率(%) |
60 |
43 |
28 |
15 |
根据表中数据分析:升高温度,平衡常数K值
减小
减小
(填“增大”、“减小”或“不变”);上述反应的焓变△H
<
<
0(填“>”、“<”或“=”).
③其它条件不变,适当提高c(CO
2),则乙醇的产量
增大
增大
(填“增大”、“减小”或“不变”,下同.),此时K值
不变
不变
.
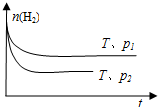
④在一定温度下,H
2的物质的量随时间的变化曲线如图,则p
1<
<
p
2(填“>”、“<”或“=”).

 (1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式
(1)经测定,20g氢气在氧气中燃烧生成水蒸气,放热2418.0kJ,写出该反应的热化学方程式 “氢”既是重要的化工原料,也是未来最理想的新能源.
“氢”既是重要的化工原料,也是未来最理想的新能源.