
题目列表(包括答案和解析)
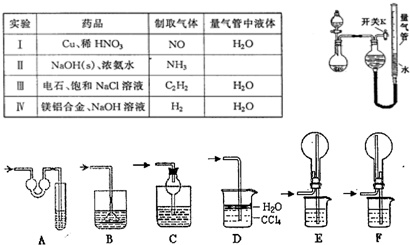
| 编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
| ① | 1.0g | 10.0mL | 346.3mL |
| ② | 1.0g | 10.0mL | 335.0mL |
| ③ | 1.0g | 10.0mL | 345.7mL |

(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题:
①气体X的分子式是 。
②所选择的药品a是 ,b是 , c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)
④请写出在试管a中所发生反应的化学方程式 。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出 ; ;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象: 。
(共13分)(1)右图甲中装置甲是某种不溶于水的气体X的发生装置和收集装置(必要时可以加热),所用的试剂从下列试剂中选取2-3种:硫化亚铁、二氧化锰、铜屑、氯化铵、稀氨水、大理石、浓硫酸、浓硝酸、稀硝酸、蒸馏水。
回答下列问题: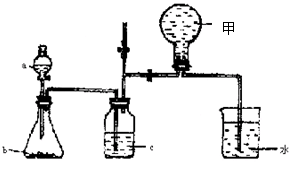
①气体X的分子式是 。
②所选择的药品a是 ,b是 , c是 。
③下列装置乙和丙,能代替装置甲的简易装置是 (填“乙”或“丙”)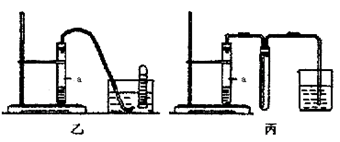
④请写出在试管a中所发生反应的化学方程式 。
⑤从反应开始到反应结束,预期在试管a中可观察到的气体的实验现象有哪些,请依次逐步写出 ; ;
(2)在进行研究性学习的过程中,学生发现等质量的铜片分别与等质量均过量的浓硝酸或稀硝酸反应,所得到溶液前者呈绿色,后者呈蓝色,针对这种现象,学生进行了讨论,出现两种意见,一种认为:Cu2+浓度差异引起了这种现象,你认为 (填“正确”或“不正确”),依据是: ;
另一种意见是:溶液呈绿色可能是Cu2+与NO2混合的结果,并用实验进行了证明,请简述实验方案与实验现象: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com