
题目列表(包括答案和解析)
(10分)实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃下发生反应。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水氯化钙干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硝酸和浓硫酸混合酸时,操作注意事项是 ;
(2)步骤③的加热方式是 ;
(3)步骤④中,洗涤后分离粗硝基苯应使用的仪器是 ;
(4)步骤④中,粗产品用5%的NaOH溶液洗涤的目的是 ;
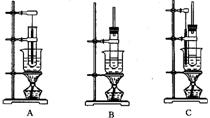
(5)现有三种实验装置,如下图所示,要制备硝基苯,应选用 ( )

实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃下发生反应。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水氯化钙于燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硝酸和浓硫酸混合酸时,操作注意事项是 ;
(2)步骤③的加热方式是 ;
(3)步骤④中,洗涤、分离粗硝基苯应使用的仪器是 ;
(4)步骤④中,粗产品用5%的NaOH溶液洗涤的目的是 ;
(5)现有三种实验装置,如下图所示,要制备硝基苯,应选用 ( )
(10分)实验室制备硝基苯的主要步骤如下:
①配制一定比例的浓硫酸和浓硝酸的混合酸加入反应器中。
②向室温下的混合酸中逐滴加入一定量的苯,充分振荡,混合均匀。
③在50℃~60℃下发生反应。
④除去混合酸后,粗产品依次用蒸馏水和5%的NaOH溶液洗涤,最后用蒸馏水洗涤。
⑤将用无水氯化钙干燥后的粗硝基苯进行蒸馏,得到纯硝基苯。
(1)配制一定比例浓硝酸和浓硫酸混合酸时,操作注意事项是 ;
(2)步骤③的加热方式是 ;
(3)步骤④中,洗涤后分离粗硝基苯应使用的仪器是 ;
(4)步骤④中,粗产品用5%的NaOH溶液洗涤的目的是 ;
(5)现有三种实验装置,如下图所示,要制备硝基苯,应选用 ( )


 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。  7N2+12H2O(NO 也有类似的反应)
7N2+12H2O(NO 也有类似的反应)


 分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。
分别表示N2、H2、NH3。图⑤表示生成的NH3离开催化剂表面,图②和图③的含义分别是__________________、__________________。  7N2+12H2O(NO 也有类似的反应)
7N2+12H2O(NO 也有类似的反应)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com