
题目列表(包括答案和解析)
| 元素 | 相关信息 |
| A | A原子的核外电子总数等于其基态电子层数 |
| B | B原子的最外层电子数是次外层电子数的2倍 |
| C | C的基态原子L电子层中有3个未成对电子 |
| D | D的外围电子层排布为(n+1)d3n(n+2)sn |
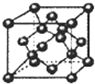

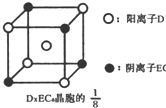
| 元素 | Mn | Fe | |
| 电离 能/kj?mol-1[来源:] |
Ⅰ1 | 717 | 759 |
| Ⅱ2 | 1509 | 1561 | |
| Ⅲ3 | 3248 | 2957 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |

(14分)A、B、C、D是四种短周期元素,E是过渡元素。A、B、C同周期,C、D同主族,A的原子结构示意图为: ,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
,B是同周期第一电离能最小的元素,C的最外层有三个成单电子,E的外围电子排布式为3d64s2。回答下列问题:
(1)写出下列元素的符号:A ________ C ________
(2)用化学式表示上述五种元素中最高价氧化物对应水化物酸性最强的是__________,碱性最强的是_________。
(3)用元素符号表示D所在周期(除稀有气体元素外)电负性最大的元素是__________。
(4)D的氢化物比C的氢化物的沸点__________(填"高"或"低"),原因_____________
(5)E元素在周期表的第_______周期________族,已知元素周期表可按电子排布分为s区、p区等,则E元素在_______区。
(6)用电子式表示B的硫化物的形成过程:_________________________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com