某学校研究性学习小组的三位同学,欲用浓硝酸来测定其铜银合金中铜的质量分数。已知:在反应过程中,随着浓硝酸浓度的降低,还原产物中还会有NO生成。请针对这三位同学的设计,完成下列问题:

(1)甲同学取合金样品14.0 g加入A中,然后将装置A、B相连,并向A中加入13.0 mol·L-1的硝酸25.0 mL充分反应后测得生成气体的体积为2.24 L(标准状况下),及反应后容器A中溶液H+浓度为1.0 mol·L-1(假设反应后溶液体积不变)。利用以上数据,你认为甲同学能得到合金中铜的质量分数吗?如果能,请写出计算过程及结果;如果不能,请简述理由。
(2)乙同学将装置A、C相连,向A中加入w g合金样品和足量浓硝酸充分反应,将生成的气体简单作了吸收处理后,便向反应后的A溶液中加入一种常见试剂,充分反应后,再经过简单的实验操作就达到了目的。请你简述他的实验思路。
(3)丙同学将装置A、D相连,向A中加入一定质量的合金样品和足量浓硝酸,充分反应后用排水集气法测定了生成气体的体积,也达到了实验目的。
①D中发生反应的化学方程式:______________________________________________。
②假设已知合金中Cu、Ag的总物质的量为a mol,水洗后气体的体积是b L(标准状况下),则合金中Cu的物质的量是___________。(结果不必简化)

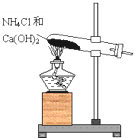 实验室通常用如图所示的装置来制取氨气.回答下列问题:
实验室通常用如图所示的装置来制取氨气.回答下列问题: