
题目列表(包括答案和解析)
(12分)Ⅰ.煤燃烧的反应热可通过以下两个途径来利用:a. 利用煤在充足的空气中直接燃烧产生的反应热;b. 先使煤与水蒸气反应得到氢气和一氧化碳,然后使得到的氢气和一氧化碳在充足的空气中燃烧。这两个过程的热化学方程式为:
C(s)+O2(g)=CO2(g); ΔH=E1 ①
C(s)+H2O(g)=CO(g)+H2(g) ΔH=E2 ②
H2(g)+1/2O2(g)=H2O(g); ΔH=E3 ③
CO(g)+1/2O2(g)=CO2(g); ΔH=E4 ④,
试回答下列问题
(1)与途径a相比,途径b有较多的优点,即 。
(2)上述四个热化学方程式中ΔH>0的反应有 。
(3)等质量的煤分别通过以上两条不同途径产生的可利用的总能量关系正确的是 。
A.a比b多 B. a比b少 C. a与b在理论上相同 D. 两者无法比较
Ⅱ.氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。
已知: CH4(g)+H2O(g)=CO(g)+3H2(g) ΔH=+206.2kJ·mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g) ΔH=+247.4 kJ·mol-1
以甲烷为原料制取氢气是工业上常用的制氢方法。CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为 。
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是 ( )
| A.H2O(g)=H2(g)+1/2O2(g)ΔH=+285.8kJ·mol-1 |
| B.2H2(g)+O2(g)=2H2O(l)ΔH=—517.6kJ·mol-1 |
| C.H2(g)+1/2 O2(g)=H2O(g)ΔH=—285.8kJ·mol-1- |
| D.2H2(g)+O2(g)=2H2O(l)ΔH=+517.6J·mol-1 |
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是 ( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+285.8kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=—517.6kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g) ΔH=—285.8kJ·mol-1-
D.2H2(g)+O2(g)=2H2O(l) ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=—2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2 (g) =1/4 P4O10(s) ΔH=—738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式_________________________________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)
(1)已知:在1×105Pa条件下,氢气的标准燃烧热是285.8 kJ·mol-1,下列热化学方程式正确的是 ( )
A.H2O(g)=H2(g)+1/2O2(g) ΔH=+285.8kJ·mol-1
B.2H2(g)+O2(g)=2H2O(l) ΔH=—517.6kJ·mol-1
C.H2(g)+1/2 O2(g)=H2O(g) ΔH=—285.8kJ·mol-1-
D.2H2(g)+O2(g)=2H2O(l) ΔH=+517.6J·mol-1
(2)科学家盖斯曾提出:“不管化学过程是一步完成或分几步完成,这个总过程的热效应是相同的。”利用盖斯定律可测某些特别反应的热效应。
① P4(s,白磷)+ 5O2(g)=P4O10(s); ΔH=—2983.2kJ·mol-1
② P(s,红磷)+ 5/4 O2 (g) =1/4 P4O10(s) ΔH=—738.5kJ·mol-1-
则白磷转化为红磷的热化学方程式_________________________________。相同的状况下,能量较低的是_________;白磷的稳定性比红磷___________(填“高”或“低”)
(14分)
(1)燃料电池作为绿色能源得到迅速发展,二甲醚(CH3OCH3)质子交换膜燃料电池的电池反应为:CH3OCH3+3O2 2CO2+3H2O,制取二甲醚的反应如下:
2CO2+3H2O,制取二甲醚的反应如下:
CO(g)+H2O(g) CO2(g)+H2(g)
△H=-41.2kJ·mol-1
CO2(g)+H2(g)
△H=-41.2kJ·mol-1
CO(g)+2H2(g) CH3OH(g)
△H=-90.7kJ·mol-1
CH3OH(g)
△H=-90.7kJ·mol-1
2CH3OH(g) CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
CH3OCH3(g)+H2O(g) △H=-23.5kJ·mol-1
①写出由CO和H2制取二甲醚和CO2的热化学方程式: 。
②二甲醚质子交换膜燃料电池是以酸性溶液为电解质溶液,二甲醚从一个电极通入,O2从另一电极通入,中间为质子交换膜,通入O2的一极为 极,电极反应式为
(2)钢铁工业是国家工业的基础。请回答钢铁冶炼、腐蚀、防护过程的有关问题。
①工业用热还原法炼铁,写出由CO还原赤铁矿(主要成分为Fe2O3)的化学方程式:
_________________________________________________________
②生产中可用盐酸来除铁锈。现将一生锈的铁片放入盐酸中,当铁锈被除尽后,溶液中发生的化合反应的化学方程式____________________________________________________
③下列哪个装置可防止铁棒被腐蚀_____________
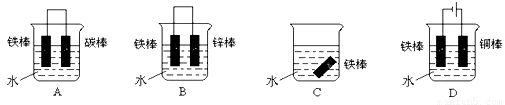
④在实际生产中,可在铁件的表面镀铜防止铁被腐蚀。装置示意图如下,请回答:
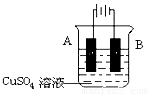
A电极对应的金属是 (写元素名称),
B电极的电极反应式是 ________________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com