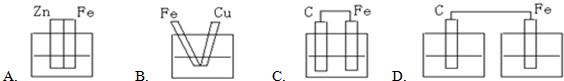
(1)将一块纯净的锌片插入盛有稀硫酸的烧杯里,可观察到锌片逐渐溶解,并有气体产生,再平行地插入一块铜片,可观察到铜片上
没有
没有
(填“有”或“没有”)气泡产生.用导线将锌片和铜片连接起来(如图a所示),可观察到铜片上
有
有
(填“有”或“没有”)气泡产生.
(2)用导线连接灵敏电流计的两端后,再与溶液中的锌片和铜片相连接(如图b所示),观察到灵敏电流计的指针发生偏转,说明导线中有电流通过.从上述现象可以归纳出构成原电池的某些条件是:
两电极要同时插入电解质溶液中,并用导线连接起来形成闭合回路
两电极要同时插入电解质溶液中,并用导线连接起来形成闭合回路
,电极反应式是:锌片
Zn-2e-=Zn2+
Zn-2e-=Zn2+
;铜片
2H++2e-=H2↑
2H++2e-=H2↑
.
(3)可见,图b是一个将
化学
化学
能转化为
电
电
能的装置,被称为原电池.我们也可以用家庭常见的一些仪器和物品,自制一个原电池,请你尝试涉及实验,并将你所设计的原电池简图画在右面的方框内:
所需物品及仪器:
水果(或果汁等电解质溶液)、铜片、锌片、导线、灵敏电流计(或小灯泡等)
水果(或果汁等电解质溶液)、铜片、锌片、导线、灵敏电流计(或小灯泡等)
.
实验操作步骤及现象:
将铜片和锌片同时插入水果中,用导线连接铜片、灵敏电流计和锌片,可以看到电流表指针发生偏转(或小灯泡发光),即形成了原电池
将铜片和锌片同时插入水果中,用导线连接铜片、灵敏电流计和锌片,可以看到电流表指针发生偏转(或小灯泡发光),即形成了原电池
.

 (1)写出图①中电解池阴阳两极的电极反应式和该电解池的总反应式:
(1)写出图①中电解池阴阳两极的电极反应式和该电解池的总反应式:
 Zn-MnO2干电池应用广泛,其示意图如下,电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其示意图如下,电解质溶液是ZnCl2-NH4Cl混合溶液.