15、喷泉是一种常见的自然现象,其产生原因是存在压强差.
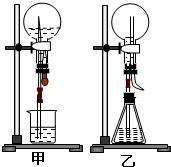
(1)图甲为化学教学中所用的喷泉实验装置.
某同学用该装置进行了如下实验:在烧瓶中收集干燥的CO
2气体,胶头滴管中加入了足量的浓NaOH溶液,烧杯中盛有滴有酚酞的蒸馏水.实验时,首先将胶头滴管中的浓NaOH溶液挤入烧瓶中,振荡使其充分反应后,按图所示安装好.
①当打开止水夹时,看到喷泉现象产生,产生喷泉现象的原因是
二氧化碳与氢氧化钠反应,使烧瓶内气压减小
.
②实验中观察到烧瓶中液体变红色,说明液体显
碱性
.
③为保护实验成功,你认为实验时应注意的问题是:
氢氧化钠浓度要大,装置气密性要良好
.
(2)图乙为重新设计的喷泉装置.
①在图乙的锥形瓶中,分别加入足量如下物质,反应后可能产生喷泉的是
B、D
.(填序号)
A.CuCl
2与NaOH溶液 B.Na
2CO
3与稀盐酸C.MnO
2固体与KClO
3D.金属锌与稀硫酸
②能形成这种喷泉的反应条件是
产生压强差
.
③在图乙中锥形瓶外放一大烧杯,锥形瓶中加入酒精,大烧杯中加入冷水后,再加入足量下列物质,结果也产生了喷泉,大烧杯中加入的物质可能是
C
.(填序号)
A.固体氢氧化钠 B.硝酸铵 C.浓硫酸 D.生石灰
(3)比较图甲和图乙两套装置,从产生喷泉原理来分析,它们的不同点是:图甲
烧瓶内压强减小,产生压力差
.图乙
锥形瓶内压强增大,产生压力差
.
(4)在自然界和人类社会生活中,与上述图乙装置原理相似的现象有
广场喷泉
(仅举一例).

 15、喷泉是一种常见的自然现象,其产生原因是存在压强差.
15、喷泉是一种常见的自然现象,其产生原因是存在压强差.