
题目列表(包括答案和解析)
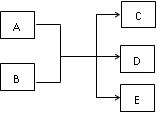
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。 
(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与K I在溶液中反应的离子方程式是
I在溶液中反应的离子方程式是  。
。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不 能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是
能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是  。
。
(3)上述(1)、(2)中的D都能使品红溶液褪 色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
(10分)在一定条件下,物质A~E转化关系如下图所示,其中A为单质,常温下E为无色液体。

(1)若A、C、D均含氯元素,C为氯碱工业的原料,D的溶液具有漂白性。
①A与B反应的化学方程式是 。
②D的溶液可使KI淀粉溶液显蓝色,则D与KI在溶液中反应的离子方程式是 。
③检验C中所含阴离子的实验方法是 。
(2)若A为银白色金属,B为某酸的浓溶液。常温下该反应不能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是 。
(3)上述(1)、(2)中的D都能使品红溶液褪色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
 I在溶液中反应的离子方程式是
I在溶液中反应的离子方程式是  。
。 能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是
能进行,加热后可以发生反应。C可用于做净水剂,D为可形成酸雨的无色气体。C与过量氢氧化钠溶液反应的离子方程式是  。
。 色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。
色,利用褪色后的溶液探究使其褪色的物质的实验方法是 。为探究铁与浓硫酸在加热条件下的反应,某活动小组设计并完成以下实验:
(1)实验目的:分析铁与浓硫酸在加热条件下的反应。

①洗气瓶中浓硫酸的作用是 。
②写出加热条件下铁与浓硫酸反应生成SO2的化学方程式 。
活动小组预测随着反应的进行,硫酸的浓度降低,可能还会有氢气产生,为进一步确认气体的成分还需要进行进一步的实验。
(2)实验目的:检验气体的成分。
试剂:氢氧化钠溶液、浓硫酸、氧化铜粉末、无水硫酸铜固体、品红溶液、高锰酸钾酸性溶液、碱石灰。
仪器如下图(可重复使用,可根据需要取用);

①连接仪器。将装置的字母填入□内,并将试剂名称填写在相应的括号内(可不填满)

②若混合气体中含有氧气,实验过程中能观察到的现象是 。
(3)实验目的:确定产物的含量。
①若混合气体中含有SO2和H2,为测定混合气体中各成分含量,需收集的数据有 。
②若反应后烧瓶中溶液含有的金属阳离子有Fe2+、Fe3+,其中检验是否含有Fe3+可采用的试剂为 ;如果该过程中共消耗了11.2g铁,反应后的溶液能吸收标准状况下1.12L氯气,则原溶液中含有Fe3+的物质的量为 mol。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com