20、小明同学从资料中得知,金属过氧化物常用作宇宙飞船或潜水艇中的氧气再生剂.对金属过氧化物用作氧气再生剂的化学原理,小明同学进行了如下探究,请你参与.
[查阅资料]a.金属过氧化物(如过氧化钠:Na
2O
2)能与二氧化碳反应生成一种白色固体和氧气;
b.过氧化钠与水、盐酸等物质反应也能生成氧气;
c.碳酸氢钠能与盐酸反应生成碳酸钠、水和二氧化碳,而碳酸氢钠与二氧化碳不反应.
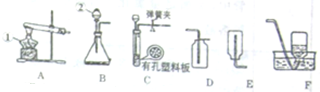
[设计实验]实验Ⅰ:小明同学用下图所示的实验验证反应生成了氧气.

(1)小明同学在实验室制取CO
2时,选择发生装置时应考虑的因素是
AC
(填序号).
A.反应物的状态B.CO
2的溶解度和密度
C.反应是否需要加热D.CO
2是否有毒
(2)根据上述因素,制取CO
2时,应从上图1、图2、图3中选择
图2
.写出实验室制取二氧化碳的化学方程式
CaCO3+2HCl=CaCl2+H2O+CO2↑
.
(3)设计A、B装置的目的是得到纯净且干燥的CO
2气体.其中A装置的作用是
除去二氧化碳中混有的HCl
;B装置主要目的是干燥CO
2气体,连接这一装置的理由是
过氧化钠与水反应也会产生氧气
,那么B中所装的试剂是
A
(填序号).
A.浓硫酸B.固体NaOH C.生石灰
(4)为了确定CO
2根Na
2O
2反应产生的气体是氧气,最后还要采用的验证实验操作及现象是
将带火星的木条放在D处导管口,木条复燃
.
(5)表明二氧化碳没有被过氧化钠完全吸收的现象是
C中的石灰水变浑浊
,该反应的化学方程式为
Ca(OH)2+CO2=CaCO3↓+H2O
.
实验Ⅱ探究反应生成的白色固体的成分.
[提出猜想]①该白色固体是氢氧化钠;②该白色固体是碳酸钠.
小明的两个猜想中一定错误的是猜想
①
(选填“①”或“②”),理由是
反应物二氧化碳与过氧化钠中没有氢元素,根据质量守恒定律,不可能生成含有氢元素的氢氧化钠
.
[设计实验]小明通过以下实验验证了另一个猜想是正确的.

[交流与讨论](1)综合实验Ⅰ、Ⅱ,小明同学写出了过氧化钠与二氧化碳反应的化学方程式
2Na2O2+2CO2=2Na2CO3+O2
.
(2)请你根据上述实验简述过氧化钠作为氧气再生剂的化学反应原理
过氧化钠能吸收呼出气体中的二氧化碳,转化为能供给呼吸的氧气
.

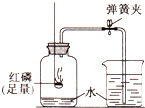 某同学用如图所示的装置测定空气中氧气的体积分数.
某同学用如图所示的装置测定空气中氧气的体积分数.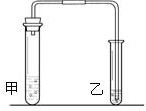 我们在学习碳酸钠和碳酸氢钠的时候,做过如下图装置的实验.向盛有0.5g碳酸钠的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象.用碳酸氢钠代替碳酸钠进行上述实验,观察现象.
我们在学习碳酸钠和碳酸氢钠的时候,做过如下图装置的实验.向盛有0.5g碳酸钠的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管另一端通入盛有澄清石灰水的试管中,观察现象.用碳酸氢钠代替碳酸钠进行上述实验,观察现象.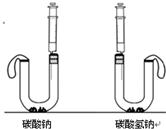 请对上述实验方案分析评价.
请对上述实验方案分析评价.
