
题目列表(包括答案和解析)
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置。请回答下列问题: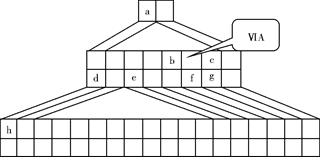
(1)请在上图中将铁元素所在族的位置全部涂黑。
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”。请写出NaH的电子式 。
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带 (“正”或“负”)电荷。
(4)下列叙述正确的是 。
| A.h的最高价氧化物对应的水化物是一种强碱 |
| B.硒化氢的稳定性强于f的氢化物的稳定性 |
| C.c的氢化物的水溶液是强酸 |
| D.原子半径:h>e>a |
下图是由Emil Zmaczynski设计的金字塔式元素周期表的一部分,图上标有第ⅥA族和几种元素的位置.请回答下列问题:
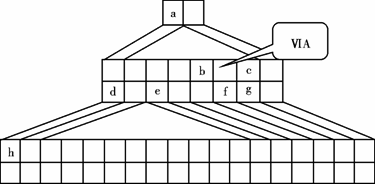
(1)请在上图中将铁元素所在族的位置全部涂黑.
(2)自从周期表诞生以来,关于氢元素在周期表中的位置,一直存在纷争,有人主张把它放在第ⅦA族,理由是:氢的最外层电子“饱和缺一”.请写出NaH的电子式________.
(3)b元素的氢化物与其最高价氧化物的水化物可生成一种盐,土壤中施用该盐做化肥时,其阴离子在水田中的利用率低,说明土壤胶体粒子带________(“正”或“负”)电荷.
(4)下列叙述正确的是________.
A.h的最高价氧化物对应的水化物是一种强碱
B.硒化氢的稳定性强于f的氢化物的稳定性
C.c的氢化物的水溶液是强酸
D.原子半径:h>e>a
E.相同条件下,d与f形成的化合物水溶液的pH大于d与g形成的化合物水溶液的pH,说明相同浓度氢化物水溶液的酸性f弱于g
(5)d的某化合物呈淡黄色,可与氯化亚铁溶液反应生成红褐色沉淀和能使带火星的木条复燃的气体,若沉淀和气体的物质的量之比为2∶1,反应的离子方程式为________.
(8分)钠、镁、铝是重要的金属元素,与我们的生活和生产关系密切。
(1)元素的性质特别是化学性质取决于元素原子结构。钠离子的电子排布式为_______,铝元素的原子结构示意图为_________。
(2)钠、镁、铝元素的阳离子半径由小到大的顺序是_____________(用离子符号表示)。在短周期中非金属性最强的元素位于第____周期____族。
(3)钠、镁、铝的单质及其化合物在某些性质上存在着递变规律。下列有关说法正确的是___________(选填编号)。
a.三种元素的金属性越强,金属单质的熔点就越高
b.其碱性按NaOH、Mg(OH)2、Al(OH)3顺序依次减弱
c.常温下都能与浓硝酸剧烈反应生成硝酸盐,但剧烈程度依次减弱
d.等质量的钠、镁、铝与足量稀硫酸反应生成氢气的物质的量依次增加
(4)1932年,美国化学大师Linus Pauling提出电负性(用希腊字母χ表示)的概念,用来确定化合物中原子某种能力的相对大小。LinusPauling假定氟元素的电负性为4,并通过热化学方法建立了其他元素的电负性。第三周期主族元素的电负性如下:
| 元素 | Na | Mg | Al | Si | P | S | Cl |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 |
从上表可以看出电负性的大小与元素非金属性的强弱关系是____________________;大量事实表明,当两种元素的χ值相差大于或等于1.7时,形成的化合物一般是离子化合物,根据此经验规律,AlBr3中的化学键类型应该是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com