
题目列表(包括答案和解析)
(04年全国卷)(l4分) 科学家发现某药物M能治疗心血管疾病是因为它在人体内能释放出一种“信使分子”D,并阐明了D在人体内的作用原理。为此他们荣获了1998年诺贝尔生理学或医学奖。
请回答下列问题:
(1)已知M的分子量为227,由C、H、O、N周四种元素组成,C、H、N的质量分数依次为15.86%、2.20%和18.50%。则M的分子式是_____________________。D是双原子分子,分子量为30,则D的分子式为________________。
(2)油脂A经下列途径可得到M。

反应①的化学方程式是_________________________________________________________________________。
反应②的化学方程式是_________________________________________________________________________。
(3)C是B和乙酸在一定条件下反应生成的化合物,分子量为134,写出C所有可能的结构简式
____________________________________。
(4)若将0.1mol B与足量的金属钠反应,则需消耗_________g金属钠。
(04年全国卷)(l6分) 粉末状试样A是由等物质的量的MgO和Fe2O3组成的混合物。进行如下实验:
①取适量A进行铝热反应,产物中有单质B生成;
②另取20 g A全部溶于0.15 L 6.0 mol?![]() 盐酸中,得溶液C;
盐酸中,得溶液C;
③将①中得到的单质B和溶液C反应,放出 l.12 L(标况)气体,同时生成溶液D,还残留有固体物质B;
④用KSCN溶液检验时,溶液D不变色。
请填空:
(1)①中引发铝热反应的实验操作是_____。产物中的单质B是__________________。
(2)②中所发生的各反应的化学方程式是_______________。
(3)③中所发生的各反应的离子方程式是________________。
(4)若溶D的体积仍视为0.15 L,则该溶液中c(Mg2+)为_____________________________,
c(Fe2+)为____________________________________________________。

| 滴定次数 | 待测液体积 | 标准KOH溶液体积/ml | 滴定前读数/ml | 滴定后读数/ml | 第一次 | 20.00 | 0.02 | 25.00 | 第二次 | 20.00 | 0.01 | 25.03 | 第三次 | 20.00 | 0.03 | 26.35 |
(08年全国卷Ⅱ)(15分)Q、R、X、Y、Z为前20号元素中的五种,Q的低价氧化物与X单质分子的电子总数相等,R与Q同族,Y和Z的离子与Ar原子的电子结构相同且Y原子序数小于Z。.
(1)Q的最高价氧化物,其固态属于 ____ 晶体,俗名叫 ____ :
(2)R的氢化物分子的空间构型是____ ,属于 ____ 分子(填“极性”或“非极性”);它与X形成的化合物可作为一种重要的陶瓷材料,其化学式为 _____ ;
(3)X的常见氢化物的空间构型是______ ,它的另一氢化物X2H4是火箭燃料的成分,其电子式是____ ;
(4)Q分别与Y、Z形成的共价化合物的化学式是____ 和 ____ ;Q与Y形成的化合物的电子式为 ___ ,属于 ____ 分子(填“极性”或“非极性”)。
[2012·全国卷](12分)氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如图所示步骤进行操作。
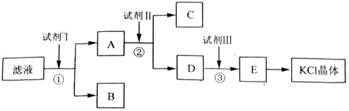
回答下列问题:
(1)起始滤液的pH_ _7(填“大于”、“小于”或“等于”),其原因是____________;
(2)试剂Ⅰ的化学式为______,①中发生反应的离子方程式为___________ ______;
(3)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是____________ ________;
(4)试剂Ⅲ的名称是________,③中发生反应的离子方程式为_________ ____;
(5)某同学称取提纯的产品0.775 9 g,溶解后定容在100 mL容量瓶中,每次取25.00 mL溶液,用0.100 0 mol·L-1的硝酸银标准溶液滴定,三次滴定消耗标准溶液的平均体积为25.62 mL,该产品的纯度为_________________________________(列式并计算结果)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com