
题目列表(包括答案和解析)
|
背景材料:①2005年10月12日,“神舟六号”发射升空;②2005年10月,河南省鹤壁市发生煤矿“瓦斯”爆炸;③近期,黄冈市举行“液氯泄漏”预警演习;④据湖北省环境质量监测所抽查显示,新装修住房甲醛含量7成超标.据此判断,下列说法正确的是 | |
| [ ] | |
A. |
“神六”遨游太空时,在其轨道舱中无法完成“粗盐的提纯”实验 |
B. |
“瓦斯”爆炸最猛烈时,煤矿坑道中甲烷的体积分数为33.3% |
C. |
发生“液氯泄漏”时,应疏导群众就近向地下商场转移 |
D. |
为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水 |
|
背景材料:①“神舟六号”的防护层由聚四氟乙烯和玻璃纤维布组合而成;②光化学烟雾是导致珠三角地区空气质量下降的重要原因;③近期,黄冈市举行“液氯泄漏”预警演习;④据湖北省环境质量监测所抽查显示,新装修住房甲醛含量7成超标.⑤在广东、香港海域,渤海湾均出现过大面积的赤潮.据此判断,下列说法正确的是 (1)“神舟六号”的防护层是复合材料,四氟乙烯属于不饱和烃. (2)光化学污染主要是由氮氧化物和碳氢化物引起的. (3)发生“液氯泄漏”时,应疏导群众立即逆风向高处远离出事地点 (4)为降低甲醛含量,新装修住房应紧闭门窗,并放置一盆水 (5)赤潮是指在一定条件下海洋中某些生物短时间内大量繁殖或聚集,使海水变红色、褐色的现象 | |
| [ ] | |
A. |
(1)(2)(3) |
B. |
(1)(2)(5) |
C. |
(2)(3)(5) |
D. |
(2)(4)(5) |
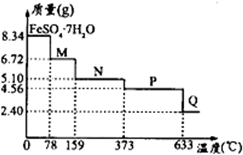 将8.34g FeSO4?7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示.则下列说法正确的是( )
将8.34g FeSO4?7H2O样品隔绝空气加热脱水,其热重曲线(样品质量随温度变化的曲线)如图所示.则下列说法正确的是( )| A、FeSO4?7H2O晶体中有4种不同结合力的水分子 | ||||
| B、在100℃时,M的化学式为FeSO4?6H2O | ||||
| C、在200℃时,N的化学式为FeSO4?3H2O | ||||
D、380℃的P加热至650℃时的化学方程式为:2FeSO4
|

 三种基团,无环状结构,三种基团的数目关系为n3=
三种基团,无环状结构,三种基团的数目关系为n3=湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com