
题目列表(包括答案和解析)
[2012·江西省重点中学协作体高三第二次联考] X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是 ( )
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
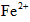 34%~36%,是糖衣片,……,与
34%~36%,是糖衣片,……,与 (维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验:
(维生素C)同服可增加本品吸收。某同学设计实验时对其中的铁成分进行了验证。请完成该实验: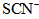 生成
生成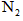 、
、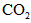 和SO42-,也可以将
和SO42-,也可以将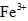 氧化成
氧化成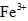 。
。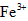 离子存在。该离子存在的原因可能是(填序号):___________________
离子存在。该离子存在的原因可能是(填序号):___________________ 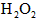 溶液,溶液的红色先变深,之后红色逐渐褪去。
溶液,溶液的红色先变深,之后红色逐渐褪去。  片,片刻后溶液红色也褪去,说明
片,片刻后溶液红色也褪去,说明 有___________性。
有___________性。
[2012·江西省重点中学协作体高三第二次联考] X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是 ( )
| A.原子半径:W>Z>Y>X>M |
| B.XZ2、X2M2、W2Z2均为直线型的共价化合物 |
| C.由X元素形成的单质不一定是原子晶体 |
| D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键 |
亚铁是血红蛋白的重要组成成分,起着向人体组织传送O2的作用,人如果缺铁就可能出现缺铁性贫血,但是摄入过量的铁也有害.下面是一种补铁药品说明书中的部分内容:该药品为无水碱式盐,含Fe2+34%~36%,是薄衣片,……,与VC(维生素C)同服可增加本品吸收.
某同学设计实验对其中的铁成分进行了验证.请一起完成该实验:
第一步:查阅资料得知,双氧水可以氧化SCN-生成N2、CO2和SO42-,也可以将Fe2+氧化成Fe3+.
第二步:向去掉糖衣、研磨好的药品中加稀盐酸,出现淡绿色浑浊液,说明有________离子存在(填离子符号);
第三步:往上述溶液中滴入几滴KSCN溶液,出现浅红色,说明溶液中有少量Fe3+离子存在.该离子存在的原因可能是(填序号):________
①药品中的铁本来就是以三价铁的形式存在;②在制药过程中生成少量三价铁;③本实验过程中有少量三价铁生成.
第四步:将第三步所得溶液分成2份,分别装在A、B两个试管中.
第五步:向A试管的溶液中加入少量稀硫酸,再慢慢滴入过量的H2O2溶液,溶液的红色先变深,之后红色逐渐褪去.
红色变深的原因是(用离子方程式表示):________;
溶液红色又褪去的原因可能是:________;
请自选中学实验室中常用仪器、药品,设计实验证明你的推测:________;
第六步:向B试管的溶液中加入一片VC片,片刻后溶液红色也褪去,说明VC有________性;怎样理解药品说明中所述“与VC同服可增加本品吸收”这句话?________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com