
题目列表(包括答案和解析)
(2007广东梅州)(1)肼(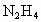 )又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0g
)又称联氨,是一种可燃性的液体,可用作火箭燃料.已知在101kPa时,32.0g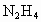 在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),
在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),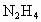 完全燃烧反应的热化学方程式是________.
完全燃烧反应的热化学方程式是________.
(2)肼-空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液.肼-空气燃料电池放电时:
正极的电极反应式是________;
负极的电极反应式是________.
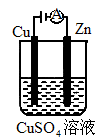
(3)图是一个电化学过程示意图.
①锌片上发生的电极反应是________.
②假设使用肼-空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼-空气燃料电池理论上消耗标准状况下的空气________L(假设空气中氧气体积含量为20%).
(4)传统制备肼的方法,是以NaClO氧化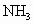 制得肼的稀溶液,该反应的离子方程式为________.
制得肼的稀溶液,该反应的离子方程式为________.
| SO | 2- 4 |
| CO | 2- 3 |
| SO | 2- 4 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com