
题目列表(包括答案和解析)
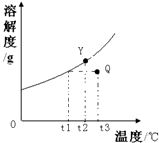 X物质的溶解度曲线如图:Y、Q两点分别表示X物质的两溶液(X从溶液中析出时不带结晶水).为了实现Y与Q之间的相互转化,下列叙述中错误的是
X物质的溶解度曲线如图:Y、Q两点分别表示X物质的两溶液(X从溶液中析出时不带结晶水).为了实现Y与Q之间的相互转化,下列叙述中错误的是(5分)物质除杂是化学实验中经常遇到的问题。
【方法探究】为除去二氧化碳气体中混有的少量一氧化碳,小明设计了三种方案。
| | 实验方案 |
| 方案A |  |
| 方案B |  |
| 方案C |  |

溶解、过滤、蒸发
1.物质的溶解[仪器:烧杯(少量用试管)、玻璃棒]
液体物质的溶解时,将水与液体混合搅拌均匀.注意在稀释浓H2SO4时,一定要把________沿器壁慢慢注入________里,并不断搅拌,使产生的热量迅速扩散.切不可将倒进________里.
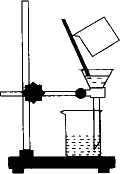
2.过滤[仪器:烧杯、玻璃棒、漏斗、铁架台(带铁圈),用品:滤纸](如下图所示)
3.蒸发[仪器:铁架台(带铁圈)、酒精灯、蒸发皿、玻璃棒]
蒸发液体时,要用玻璃棒不断搅拌液体,当蒸发皿内出现________时,即可停止加热,热的蒸发皿要用________移走,并放在________上冷却.
| Cl- | CO32- | SO42- | NO3- | OH- | |
| Ca2+ | 溶 | 难 | 微 | 溶 | 微 |
| Ba2+ | 溶 | 难 | 难 | 溶 | 溶 |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 |
图为A物质的溶解度曲线。M、N两点分别表示A物质的两种溶液。

下列做法中,不能实现M、N间的相互转化的是
A.从N→M:先向N中加入适量固体A再降温
B.从N→M:先将N降温再加入适量固体A
C.从M→N:先将M降温过滤后再将其升温
D.从M→N:先将M升温再将其蒸发掉部分水
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com