
题目列表(包括答案和解析)


下列说法正确的是
A.丁达尔效应不能区分 溶液和胶体 溶液和胶体 |
| B.一种分散系里只能有一种分散质 |
| C.以水为分散剂的分散系,按稳定性由强烈弱的顺序是:浊液、胶体、溶液 |
| D.分散系中分散质形成的粒子直径由大到小的顺序是:浊液、肢体、溶液 |
现由以下几种物质:①、Ba(OH)2固体 ②、NH4NO3晶体 ③、酒精 ④、氢氧化铁胶体 ⑤、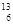 C ⑥、Na2O固体 ⑦、T2O (其中1和2问用序号回答)
C ⑥、Na2O固体 ⑦、T2O (其中1和2问用序号回答)
(1)以上物质中属于混合物的是____ ;属于盐的是 ;属于碱性氧化物的是
(2)以上物质中属于非电解质的是 ;表示一种核素的是 ;具有丁达尔效应的物质是
(3) Ba(OH)2的电离方程式
(4) NH4NO3的电离方程式
现由以下几种物质:①、Ba(OH)2固体 ②、NH4NO3晶体 ③、酒精 ④、氢氧化铁胶体
⑤、 C ⑥、Na2O固体 ⑦、T2O (其中1和2问用序号回答)
C ⑥、Na2O固体 ⑦、T2O (其中1和2问用序号回答)
(1)以上物质中属于混合物的是______ ;属于盐的是 ;属于碱性氧化物的是
(2)以上物质中属于非电解质的是 ;表示一种核素的是 ;具有丁达尔效应的物质是
(3) Ba(OH)2的电离方程式
(4) NH4NO3的电离方程式
现由以下几种物质:①、Ba(OH)2固体 ②、NH4NO3晶体 ③、酒精 ④、氢氧化铁胶体 ⑤、![]() C ⑥、Na2O固体 ⑦、T2O (其中1和2问用序号回答)
C ⑥、Na2O固体 ⑦、T2O (其中1和2问用序号回答)
(1)以上物质中属于混合物的是______ ;属于盐的是 ;属于碱性氧化物的是
(2)以上物质中属于非电解质的是 ;表示一种核素的是 ;具有丁达尔效应的物质是
(3) Ba(OH)2的电离方程式
(4) NH4NO3的电离方程式
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com