
题目列表(包括答案和解析)
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是
A.①②③④ B.②④①③
C. ④①②③ D.①④③②
【解析】若设气体的物质的量均是1mol,则①中反应为2H2S+SO2=3S+2H2O,剩余气体是0.5mol。②中不反应,气体的物质的量是2mol,③中反应是NH3+HCl=NH4Cl,没有气体剩余。④中反应为2NO+O2=2NO2,剩余气体是1.5mol。所以答案选B。
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,VLCHCl3含有的碳原子数为![]()
B.干冰晶胞中含有C=O键数目为4NA
C.标准状况下22.4L氩气,含氩原子的数目为2NA
D.1mol二氧化硅晶体中含有Si—O键的数目为4NA
【解析】标准状况下, CHCl3是液体,A错误。干冰晶胞中含有的CO2分子有8×1/8+6×1/2=4,但1个CO2分子中存在2个C=O,所以干冰晶胞中含有C=O键数目为8NA,B不正确。氩气是单原子分子,1mol中含有1mol氩原子,C不正确。硅原子有4个价电子,能形成4个Si—O键,D正确,答案是D。
设NA为阿伏加德罗常数,下列叙述中正确的是( )
A.0.3mol NO2气体溶于足量水中充分反应转移的电子总数为0.2 NA
B.7.8g Na2O2固体中含有的离子总数为0.4NA
C.标准状况下,22.4L SO3与足量水充分反应生成的H+的总数为2NA
D.0.5mol Fe与过量的硫在加热的条件下充分反应得到的电子总数为1.5NA
【解析】NO2气体溶于的方程式为3NO2+H2O=2HNO3+NO在反应中NO2既是氧化剂还是还原剂,转移的电子数是2,所以A正确。过氧化钠中阳离子和阴离子的个数之比是2︰1,所以7.8g Na2O2固体中含有的离子总数为0.3NA,即B不正确。标准状况下三氧化硫不是气体,C不正确。铁与稀硫酸反应生成的是亚铁离子,即0.5mol Fe失去的电子是1mol,D不正确。答案选A。
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是


A.①②③④ B.②④①③
C. ④①②③ D.①④③②
【解析】若设气体的物质的量均是1mol,则①中反应为2H2S+SO2=3S+2H2O,剩余气体是0.5mol。②中不反应,气体的物质的量是2mol,③中反应是NH3+HCl=NH4Cl,没有气体剩余。④中反应为2NO+O2=2NO2,剩余气体是1.5mol。所以答案选B。
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.标准状况下,VLCHCl3含有的碳原子数为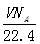
B.干冰晶胞中含有C=O键数目为4NA
C.标准状况下22.4L氩气,含氩原子的数目为2NA
D.1mol二氧化硅晶体中含有Si—O键的数目为4NA
【解析】标准状况下, CHCl3是液体,A错误。干冰晶胞中含有的CO2分子有8×1/8+6×1/2=4,但1个CO2分子中存在2个C=O,所以干冰晶胞中含有C=O键数目为8NA,B不正确。氩气是单原子分子,1mol中含有1mol氩原子,C不正确。硅原子有4个价电子,能形成4个Si—O键,D正确,答案是D。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com