
题目列表(包括答案和解析)
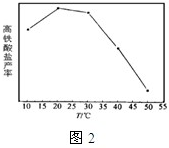
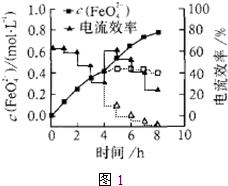


| 提出问题 | 收集资料 | 提出假设 | 验证假设 | 得出结论 |
| 氯水中何种物质能使湿润的红色布条褪色 | ①氯气有强氧化性 ②氯气与冷水反应生成盐酸和次氯酸 ③次氯酸有强氧化性 |
① ② ③ ④H2O使布条褪色 |
实验①:把红色干布条放入充满氯气的集气瓶中,布条不褪色 实验②: 实验③: 实验④:把红色布条放在水里布条不褪色 |
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2 。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为 、 ;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: O2— + H2O = H2O2+ O2+
(3)Na2O2、K2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(4)高温下,超氧化钾晶体呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为
已知碱金属的氧化物有:普通氧化物,如Li2O;过氧化物,如Na2O2;超氧化物,如KO2;臭氧化物,如RbO3,其中后三者均能与H2O或CO2反应产生O2。
(1)宇航工业,为了能保持飞船座舱内空气成分的稳定,宇航科学家进行了大量的探索,有的科学家提出了“金属过氧化物处理系统”。即不断把座舱内的空气通过盛有金属过氧化物(以过氧化钠为例)的容器,并把处理后的气体充入座舱。每个宇航员平均每天需要消耗0.9 kg氧气,呼出1.0 kg二氧化碳。有关反应的化学方程式为 、 ;将处理后的气体充入座舱时,为了能保持飞船座舱内空气成分的稳定,还应采取的措施是___________________________________。
(2)人体内O2—离子对健康有害,使人过早衰老,但在催化剂SOD存在下可发生如下反应,请完成该反应的离子方程式: O2— + H2O = H2O2+ O2+
(3)Na2O2、K2O2、CaO2以及Ba O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
O2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是 (写电子式)
(4)高温下,超氧化钾晶体 呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为
呈立方体结构。晶体中氧的化合价部分为0价,部分为-2价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则每个超氧化钾晶胞含有 个K+和 个O2-;该晶体中,0价氧原子与-2价氧原子的数目比为 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com