
题目列表(包括答案和解析)
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
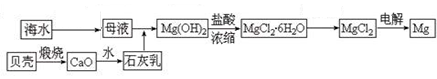
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:

主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
A.此法的优点之一是原料来源丰富
B.进行①②③步骤的目的是从海水中提取氯化镁
C.第④步电解法制取镁是由于镁是很活泼的金属
D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应
(2)步骤②不够合理,理由是
Ⅱ.(1)铝、空气、海水可组成一种电池,广泛用于制造航标灯。此电池正极的电极反应为 。
(2)铝热还原法是冶炼熔点较高的金属的一种重要方法,焊接钢轨即用到此法。将干燥的氧化铁粉末和铝粉均匀混合后放入纸漏斗中(漏斗已事先处理好),并架在铁架台上,
下面放置一个盛有沙子的蒸发皿。请写出引发铝热反应的操作及该反应的化学方程式:
操作
化学方程式 。
(3)为确定某铝热剂(氧化铁粉末和铝粉)的组成,分别进行下列实验。
若取10.7 g样品,向其中加入足量的NaOH溶液,测得生成的气体(标准状况)体积为3.36 L ,反应的化学方程式为 ,样品中铝的质量是 g。
若取10.7 g样品将其点燃,恰好完全反应,待反应产物冷却后,加入足量盐酸,测得生成的气体体积为a L,该气体与上小题中所得气体的体积比等于 ∶ 。
蛇纹石矿可以看作由MgO、Fe2O3、Al2O3和SiO2组成。某实验小组设计如下流程欲分别制得单质Al、Fe、Mg和Si。

有关氢氧化物沉淀的pH见下表:
金属阳离子 | 氢氧化物开始沉淀时的pH | 氢氧化物完全沉淀的pH |
Fe3+ | 1.9 | 3.2 |
Mg2+ | 9.4 | 11.6 |
请回答下列问题:
(1)滤液A中含有的阳离子有 。
(2)操作②中涉及的化学方程式为 ,
操作④中生成沉淀G的离子方程式为 。
(3)操作⑤中调节pH到5~6时,可以用到的试剂(填序号) 。
a. NaOH溶液 b. 氨水 c. MgO d. Mg(OH)2
(4)从滤液H制取金属Mg的流程如下:
|
流程中由MgCl2冶炼Mg的方法是 。在干燥的HCl气流中加热MgCl2?6H2O制取无水氯化镁的原因是 。
(14分)镁、铝是两种重要的金属,它们的单质及化合物有着各自的性质。
Ⅰ.海水中含有氯化镁,是镁的重要来源之一。从海水中制取镁,某同学设计了如下
流程步骤:
主要的步骤总结如下:①把贝壳制成石灰乳 ②往母液中加石灰乳,沉降、过滤,得到Mg(OH)2沉淀 ③将沉淀物与盐酸反应,结晶、过滤,将制得的晶体脱水得无水MgCl2
④将得到的产物熔融后电解。
(1)下列说法不正确的是__________________(填代号)
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
| A.此法的优点之一是原料来源丰富 |
| B.进行①②③步骤的目的是从海水中提取氯化镁 |
| C.第④步电解法制取镁是由于镁是很活泼的金属 |
| D.以上制取镁的过程中涉及的反应有分解反应、化合反应和置换反应 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com