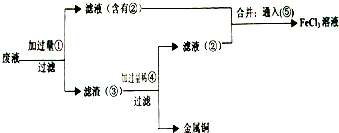
从分类角度看,金属可分为黑色金属和有色金属.铁是日常生活中最常见的黑色金属,请回答下列问题:
问题1:铁为何称为黑色金属?
(1)同学们经百度查询,得到以下两种解释,你认为下列解释正确的是
A
A
.(填字母)
A.因为铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
(2)已知某黑色粉末为铁和四氧化三铁的混合物.请定性证明其中含有Fe
3O
4(只要求简述实验方法)?
用干燥的氢气与黑色粉末加热反应,用无水硫酸铜检测显蓝色或用纯净的CO与黑色粉末加热反应,用澄清石灰水检验有白色沉淀生成,说明其中含有Fe3O4
用干燥的氢气与黑色粉末加热反应,用无水硫酸铜检测显蓝色或用纯净的CO与黑色粉末加热反应,用澄清石灰水检验有白色沉淀生成,说明其中含有Fe3O4
.
(3)将适量FeO粉末溶于过量稀硫酸中,并将所得溶液分为两份.一份溶液加入少量硝酸钾晶体,发现溶液颜色发生改变,此反应的离子方程式为
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
3Fe2++4H++NO3-=3Fe3++NO↑+2H2O
,另一份溶液加入一定量氢氧化钠溶液,所见主要实验现象为
产生白色絮状沉淀,并迅速变成灰绿色,最后变成红褐色
产生白色絮状沉淀,并迅速变成灰绿色,最后变成红褐色
.
问题2:已知CuO在高温时可分解为Cu
2O和O
2,为探究Fe
2O
3高温灼烧时是否分解为FeO和O
2,同学们设想了两种探究方法:
C.看灼烧前后固体颜色是否变化. D.看灼烧前后固体质量改变情况.
(4)实验时应将Fe
2O
3放在
坩埚
坩埚
中灼烧.(填仪器名称)
(5)方法C中,如果高温灼烧后固体颜色发生明显改变,说明Fe
2O
3发生了变化.能否说明产物一定为FeO?
不能
不能
,(填“能”或“不能”)理由是
Fe3O4也是黑色的
Fe3O4也是黑色的
.
(6)方法D中,测得实验结果是固体灼烧前后的质量比为30:29,则高温灼烧后固体生成物是
Fe3O4
Fe3O4
.

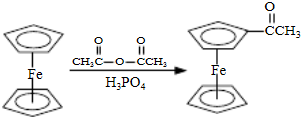
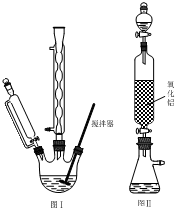 步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.
步骤1:如图Ⅰ所示,取1g二茂铁与3mL乙酸酐于装置中,开通搅拌器,慢慢滴加85%磷酸1mL,加热回流5min.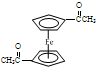 ),可以使用的仪器分析方法是
),可以使用的仪器分析方法是