
题目列表(包括答案和解析)

A.1 mol冰中有4 mol氢键 B.1 mol冰中有4×5 mol氢键
C.平均每个水分子只有2个氢键 D.平均每个水分子只有5/4个氢键
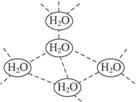
图3-34
A.1 mol冰中有4 mol氢键 B.1 mol冰中有4×5 mol氢键
C.平均每个水分子只有2个氢键 D.平均每个水分子只有5/4个氢键
水分子间可通过一种叫“氢键”的作用(介于化学键和范德瓦耳斯力大小之间),彼此结合而形成(H2O)n,在冰中的n值为5。即每个水分子都被其他4个水分子包围形成变形四面体,如图1-11所示为(H2O)5单元,由无限个这样的四面体通过氢键相互连接成一个庞大的分子晶体,即冰。下列有关叙述正确的是( )
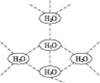
图1-11
A.1 mol冰中有4 mol氢键
B.1 mol冰中有4×5 mol氢键
C.平均每个水分子只有2个氢键
D.平均每个水分子只有5/4个氢键
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com