
题目列表(包括答案和解析)
| ||
| ||

| c3(H+) |
| c(Fe3+) |
| c3(H+) |
| c(Fe3+) |

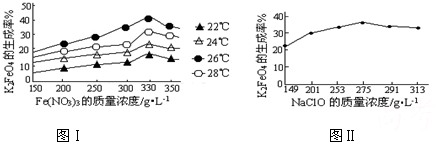
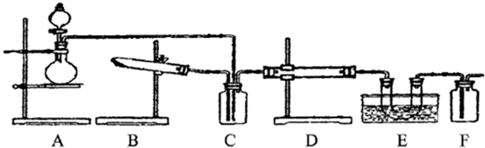
 4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
4Fe(OH)3+8OH-+3O2↑.在提纯K2FeO4时采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用
①燃料电池中两极上进行的电极反应分别为
a.正极_____________________________________________;
b.负极_____________________________________________。
②电解池中两极上进行的电极反应分别为
a.阴极_____________________________________________;
b.阳极_____________________________________________。
(2)将(1)中的“氢氧化钠溶液”改为“硫酸溶液,”其他同(1),试写出答案。
(3)若燃料电池中电解质溶液为氢氧化钠溶液,但向负极通入的气体不是氢气,而是一氧化碳(或甲烷,或乙烯,或乙炔),则原电池中两极上进行的电极反应、电池总反应和电解质溶液pH的变化分别是:
当通入一氧化碳时:
a.正极_____________________________________________;
b.负极_____________________________________________;
c.电池总反应为_____________________________________;
d.电解质溶液pH的变化为_________。(填“增大”“减小”或“不变”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com