
题目列表(包括答案和解析)
| 运用化学反应原理可以更好的分析化学反应的本质 。 (1)下列四组物质反应,其中与其它三组有本质不同的是_______。 A.Na2O2 + H2O B.F2 + H2O C.Cl2 + H2O D.NO2 + H2O (2)在 25℃下,向浓度均为 0.1mol·L-1 的NaCl和KBr混合溶液中逐滴加入硝酸银溶液,先生成_______沉淀 ( 填化学式 );当两种沉淀共存时溶液中 (3) 汽车尾气净化中的一个反应如下:2NO(g)+2CO(g)  N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: N2(g)+2CO2(g) 该反应混合体系中NO 的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题: | ||||||||
 | ||||||||
① 2NO(g)+2CO(g) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) N2(g)+2CO2(g) 的△H _____0( 填 “>” 或 “<”) ②若温度为Tl 、T2, 反应的平衡常数分别为 Kl、K2, 则K1_____K2;若反应进行到状态D 时,V正___V逆(填“>”、“<”或“=”) ③在恒容的密闭容器中,该反应达平衡后,改变某一条件,下列示意图不正确的是 | ||||||||
 | ||||||||
| (4)分析下表提供的数据: | ||||||||
| ||||||||
| ① 84 消毒液 ( 有效成分为 NaClO) 久置于空气中会失效,写出发生反应的离子方程式:____________; __________________。 ②判断在等浓度的 NaClO、NaHCO3混合溶液中,各种离子浓度由大到小的顺序:_________________。 |

 2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
2SO3(g)。反应体系中SO3的百分含量和温度的关系如下图所示(曲线上任何一点都表示平衡状态)。根据图示回答下列问题:
 0(填“>’或“<”)。
0(填“>’或“<”)。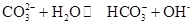 ,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。
,25℃时该反应的K=2×10-4mol·L-1,则当溶液中c(HCO- 3):c(CO2- 3)=2∶1时,溶液的pH= 。工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化: 2SO2+O2 2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是(
)
2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是(
)
A.使用催化剂是为了加快反应速率,提高生产效率
B.在上述条件下,SO2不可能100%地转化为SO3
C.达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态
D.达到平衡时,SO2的浓度与SO3的浓度相等
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化: 2SO2+O2 2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
2SO3这是一个放热的可逆反应。如果反应在密闭容器中进行,下列有关说法中错误的是( )
| A.使用催化剂是为了加快反应速率,提高生产效率 |
| B.在上述条件下,SO2不可能100%地转化为SO3 |
| C.达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态 |
| D.达到平衡时,SO2的浓度与SO3的浓度相等 |
|
工业制硫酸中的一步重要反应是SO2在400~500℃下的催化氧化:2SO2+O2 | |
| [ ] | |
A. |
使用催化剂是为了加快反应速率,提高生产效率 |
B. |
在上述条件下,SO2不可能100%地转化为SO3 |
C. |
达到平衡时,改变反应条件可以在一定程度上改变该反应的化学平衡状态 |
D. |
达到平衡时,SO2的浓度与SO3的浓度相等 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com