
题目列表(包括答案和解析)
下列反应的离子方程式书写正确的是 w.w.w.k.s.5.u. c.o.m ( )
A.用氨水吸收少量SO2气体:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.NaHSO4溶液中滴入Ba(OH)2溶液至中性:H++SO42-+Ba2+十OH-===BaSO4↓+H2O
C.在H2O2中加入酸性KMnO4溶液:2MnO4-+5H2O2+6H+====2Mn2+ +5O2↑+8H2O
D.用惰性电极电解饱和氯化钠溶液:2Cl- + 2H+ ![]() H2↑+ Cl2↑
H2↑+ Cl2↑
(8分)燃料电池具有广阔的发展前途,科学家近年研制出一种微型的燃料电池,采用甲醇取代氢气做燃料可以简化电池设计,该电池有望取代传统电池。某学生在实验室利用碱性甲醇燃料电池电解Na2SO4溶液。w.@w.w.k.&s.5*u.c.o~m
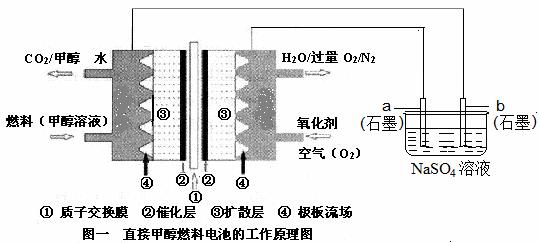
请根据图示回答下列问题: w.@w.w.k.&s.5*u.c.o~m
(1)图中a电极是 (填“正极”、“负极”、“阴极”或“阳极”)。该电极上发生的电极反应式为 。
(2)碱性条件下,通入甲醇的一极发生的电极反应式为 。
(3)当消耗3.36 L 氧气时(已折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量
是 mol。
(4)25℃、101kPa时,燃烧16g甲醇生成CO2和H2O(l),放出的热量为363.26 kJ,写出甲醇燃烧的热化学方程式: 。
(10分)江苏省拥有丰富的海洋资源,盐化工是连云港市的主要产业之一。从盐卤初步得到的光卤石(KCl?MgCl2?6H2O)晶体中,还含有约8%的NaCl。
![]() 为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
为了从光卤石中提取KCl和MgCl2,某学习小组查阅资料得到MgCl2、KCl和NaCl在不同温度下的溶解度S(g/100g水)的数据如下:
 |
![]()
![]()
![]()
![]()
![]()
并设计出下面的实验流程:w.w.w.k.s.5.u.c.o.m
![]()

![]()
![]()
![]()
![]()
根据他们提供的数据和实验回答下列问题:
![]() 问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题1:以上实验流程中晶体X的化学式为 ,若制得的X还含有少量的可溶性杂质,可用 的方法进一步提纯。操作步骤①中为趁热过滤的原因是 。
问题2:工业上采用电解无水氯化镁的方法制取金属镁。
(1)若在空气中加热MgCl2?6H2O,生成的是Mg(OH)Cl,写出反应的化学方程式:
(2)该小组同学采取将浓硫酸滴入浓盐酸制取氯化氢气体的方法,用下图的实验装置,在干燥的HCl气流中加热MgCl2?6H2O来得到无水MgCl2。装置中盛有浓硫酸的仪器分别是 (填写仪器的符号),需要加热的仪器是 (同上)。
(3)为防止对环境的污染,还需要将尾气吸收,但实验室现有的仪器和试剂只有:烧杯、导管、蒸馏水、酒精、苯、四氯化碳。请你为他们设计一个尾气的吸收装置,将装置图画在方框内并在图中标明所用试剂。

问题3:MgO则是重要的耐火材料。在550℃时,MgCl2?6H2O会分解生成MgO、MgCl2、HCl和水,若不补充其它原料,使一定量的MgCl2?6H2O全部生成a mol MgO、b mol MgCl2和36.5%的盐酸,则 a∶b≈_______(取整数值)。
已知D、M、H是常见的非金属单质,其中M是无色气体,H是有色气体,J是一种金属单质(其同族的某种元素是形成化合物种类最多的元素),A、C是金属氧化物,C和J均是某种常见电池的电极材料,J元素的+2价化合物比+4价化合物稳定,B与C反应时,每生成1 mol H同时消耗4 mol B和1 mol C,K只知含有CO或CO2中的一种或两种。它们关系如图:w_w*w.k*s 5*u.c*o m
w_w w. k#s5_u.c o*m
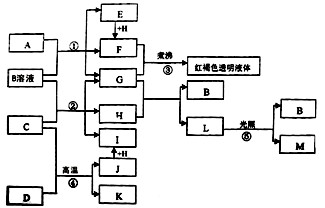
(1)写出下列物质的化学式:A D
(2)写出下列反应的化学方程式:
②
⑤
(3)由金属氧化物A和C得到其相应的金属,在冶金工业上一般可用 方法(填序号)①热分解法②热还原法 ③电解法 其中从A得到其相应金属也可用铝热法,若反应中1 mol A参加反应,转移电子的物质的量为
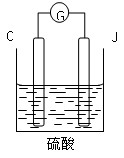
(4)用C、J作电极,与硫酸构成如下图所示电池,正极的电极反应为 当反应转移1 mol电子时,负极质量增加 gw_w*w.k*s 5*u.c*o m
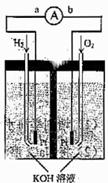 (10分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(10分) 氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是 ,在导线中电子流动方向为 (用a、b表示)。
(2)负极反应式为 。
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:w.w.w.k.s.5.u.c.o.m
Ⅰ.2Li+H2![]()
![]() 2LIH
2LIH
Ⅱ.LiH+H2O==LiOH+H2↑
①反应Ⅰ中的还原剂是 ,反应Ⅱ中的氧化剂是 。
②根据反应Ⅰ用锂吸收224L(标准状况)H2,生成的LiH与H2O作用,放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为 mol。
(4)用以上燃料电池做电源,用惰性电极电解M(NO3)x的水溶液,当阴极上增重a g时,在阳极上同时产生b L氧气(标准状况),从而可知M的相对原子质量为
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com