
题目列表(包括答案和解析)
从海水中提取镁是世界各国获得镁的主要来源,以下是制取镁的过程中涉及的几种物质的溶度积,根据你所学的知识回答下列几个问题:
|
物质 |
CaCO3 |
MgCO3 |
Ca(OH)2 |
Mg(OH)2 |
|
溶度积 |
2.8×10–9 |
6.8×10–6 |
5.5×10–6 |
1.8×10–11 |
(1)在从海水中提取镁时,往往用到贝壳(主要成份是碳酸钙),你认为 (填“能”或“不能”)将贝壳研磨成粉末直接投入海水中,理由是 ;如果不能直接投入,应将贝壳作何处理,试写出化学方程式 。
(2)某同学在实验室条件下模拟该生产过程,但实验室无石灰,他打算用烧碱代替,你认为 (填“可以”或“不可以”)得到Mg(OH)2。在加试剂时,误将纯碱溶液加入海水中,他思考了一下,又在得到的混合体系中加入过量的烧碱溶液,你觉得他 (填“能”或“不能”)将Mg2+转化为Mg(OH)2沉淀,理由是 (用离子方程式表示)。
(3)已知海水中镁离子浓度为1.8×10–3mol·L–1,则要使镁离子产生沉淀,溶液的PH最低应为 。
(8分)按要求回答下列问题
①写出Ba(OH)2溶于水时的电离方程式:
②写出工业生产氯气的化学方程式:
③写出Mg在CO2气体中点燃的化学方程式:
④写出钠和水反应的离子方程式:
Mg(OH)2在水中存在如下溶解平衡:Mg(OH)2(s) ![]() Mg2++2OH-,NH4Cl水解使溶液显酸性,其中H+与Mg(OH)2电离出来的OH-结合生成难电离的水,使Mg(OH)2的溶解平衡向右移动而溶解。为了检验其解释是否正确,学生乙用CH3COONH4(其溶液显中性)代替NH4Cl做实验,发现Mg(OH)2也溶解了。
Mg2++2OH-,NH4Cl水解使溶液显酸性,其中H+与Mg(OH)2电离出来的OH-结合生成难电离的水,使Mg(OH)2的溶解平衡向右移动而溶解。为了检验其解释是否正确,学生乙用CH3COONH4(其溶液显中性)代替NH4Cl做实验,发现Mg(OH)2也溶解了。
(1)学生甲的解释是____________(填“合理”或“不合理”),请说明理由___________________。
(2)请阐述你对Mg(OH)2溶于NH4Cl溶液的解释:____________________________________。
下列反应的离子方程式正确的是
A.Fe(OH)2溶于足量氯水:Fe(OH)2 + 2H+= Fe2++ 2H2O
B.有机物A与足量NaOH溶液共热:
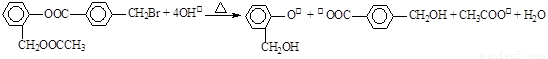
C.碳酸钠固体加入盐酸:Na2CO3 + 2H+= 2Na++ 2H2O + CO2↑
D.NaAlO2溶液与KHCO3溶液混合:AlO2-+ HCO3-+ H2O = Al(OH)3↓+ CO32-
已知:氢氧化镁能溶于浓度均为3mol/L的①盐酸②NH4Cl溶液③醋酸铵溶液(中性),下列说法正确的是
A.c(NH4+):③ > ②
B.pH:① > ② > ③
C.Mg(OH)2溶于②的主要原因是由于NH4+水解使溶液显酸性,导致平衡Mg(OH)2(s) Mg2+ (aq) + 2OH- (aq)向溶解方向移动
Mg2+ (aq) + 2OH- (aq)向溶解方向移动
D. 将等体积的①和③混合,所得溶液中 c(Cl-) >c(NH4+) > c(H+) > c(CH3COO-) > c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com