2013年全国各地都遭遇“十面霾伏”.其中,机动车尾气和燃煤产生的烟气对空气质量恶化贡献较大.
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g)
2CO
2(g)+N
2(g).△H<0
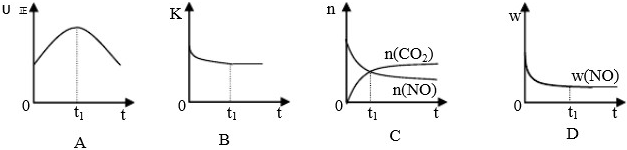
若该反应在绝热、恒容的密闭体系中进行,下列示意图甲正确且能说明反应在进行到t
1时刻达到平衡状态的是
(填代号).
(下图中υ
正、K、n、w分别表示正反应速率、平衡常数、物质的量、质量分数)
(2)机动车尾气和煤燃烧产生的烟气含氮的氧化物,用CH
4催化还原NO
X可以消除氮氧化物的污染.已知:
CH
4(g)+2NO
2(g)=N
2(g)+CO
2(g)+2H
2O(g)△H=-867kJ/mol
2NO
2(g)?N
2O
4(g)△H=-56.9kJ/mol
H
2O(g)=H
2O(l)△H=-44.0kJ/mol
写出CH
4催化还原N
2O
4(g)生成N
2和H
2O(l)的热化学方程式:
.
(3)用NH
3催化还原NO
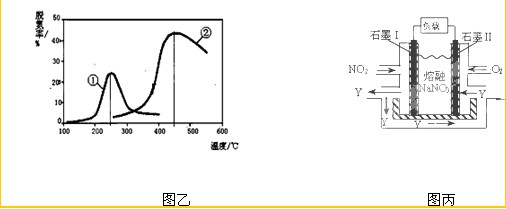
X也可以消除氮氧化物的污染.图乙,采用NH
3作还原剂,烟气以一定的流速通过两种不同催化剂,测量逸出气体中氮氧化物含量,从而确定烟气脱氮率(注:脱氮率即氮氧化物转化率),反应原理为:NO(g)+NO
2(g)+2NH
3(g)?2N
2(g)+3H
2O(g).
①该反应的△S
0,△H
0(填“>”、“=”或“<”).
②对于气体反应,用某组分(B)的平衡压强(p
B)代替物质的量浓度(c
B)也可以表示平衡常数(记作K
P),则上述反应的K
P=
.
③以下说法正确的是
.
A.第②种催化剂比第①种催化剂脱氮率高
B.相同条件下,改变压强对脱氮率没有影响
C.催化剂①、②分别适合于250℃和450℃左右脱氮
(4)NO
2、O
2和熔融NaNO
3可制作燃料电池,其原理见图丙.该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应为
.
(5)硝酸工业尾气中氮氧化物(NO和NO
2)可用尿素〔CO(NH
2)
2〕溶液除去.反应生成对大气无污染的气体.1mol尿素能吸收工业尾气中氮氧化物(假设NO、NO
2体积比为1:1)的质量为
g.


