
题目列表(包括答案和解析)
(14分)不同的金属在化学反应中表现出来的活泼程度不同,瑞典化学家贝采里乌斯和俄国化学家贝开托夫称之为金属活动顺序。另一方面,同一金属在不同条件或不同化学反应中也可以表现出不同的活泼程度。
⑴根据金属活动性顺序,工业上冶炼金属可以采用不同的冶炼方法。其中可以用“热分解法”冶炼的金属有 。
腐蚀速率/g.m-2.h-1
 ⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑵工业上用氯化铁溶液腐蚀铜制电路板。根据金属活动性顺序及该反应原理,比较Cu2+、Fe3+、Fe2+的氧化性由强到弱的顺序: 。
⑶合金Fe-Cr在不同酸中反应情况不同,其在三种稀硫
酸、稀硝酸和稀盐酸中的腐蚀速率如图所示,则下列
有关说法正确的是 (填写序号)。
A.酸的氧化性越强,对该合金的腐蚀速率越大
B.稀硝酸对该合金的腐蚀性比另两种酸弱
C.合金中Cr含量增加,稀硝酸对该合金的腐蚀性减弱
⑷已知粗铜中含有少量的锌、铁、银、金等金属和少量
|
以硫酸铜溶液为电解液,用电解的方法实现了粗铜的提纯,
并对阳极泥和电解液中金属进行回收。
步骤一:电解精制
电解时,粗铜应与电源的 极相连。电解过程中,硫酸铜的浓度会 (填“变大”、“不变”或“变小”)。
步骤二:电解完成后,该小组同学按以下流程对电解液进行处理:

稀硝酸处理阳极泥得到硝酸银稀溶液,请你写出该步反应的离子方程式: 。
残渣含有极少量的黄金,如何回收金,他们查阅了有关资料,了解到了一些有关金的知识,以下是他们获取的一些信息:
| 序号 | 反应 | 平衡常数 |
| 1 | Au + 6HNO3(浓)= Au(NO3)3 + 3NO2↑+ 3H2O | << 1 |
| 2 | Au3+ + 4Cl- = AuCl4- | >>1 |
从表中可知,金很难与硝酸反应,但却可溶于王水(浓硝酸与盐酸按体积比1:3的混合物),请你简要解释金能够溶于王水的原因: 。
氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注。
Ⅰ.某实验小组以H2O2分解为例,探究浓度、催化剂、溶液酸碱性对反应速率的影响。在常温下按照下表所示的方案完成实验。
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2%H2O2溶液 | 无 |
| ② | 10 mL 5%H2O2溶液 | 无 |
| ③ | 10 mL 5%H2O2溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ④ | 10 mL 5%H2O2溶液+少量HCl溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |
| ⑤ | 10 mL 5%H2O2溶液+少量NaOH溶液 | 1 mL 0.1 mol·L-1FeCl3溶液 |



(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
| 实验编号 试剂 | A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/ mL | 0 | 5.0 | 10.0 |
| H2O/ mL | V3 | V4 | 0 |
按要求回答下列问题:
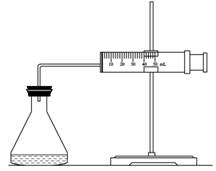
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2++ O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 +2H+ == 2Fe3+ + 2H2O。
(9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
|
实验编号 试剂 |
A |
B |
C |
|
10% H2O2/mL |
20.0 |
V1 |
V2 |
|
2mol/L FeCl3/ mL |
0 |
5.0 |
10.0 |
|
H2O/ mL |
V3 |
V4 |
0 |
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测 推(计)算反应速率。
(2)为实现实验目的,则V1= ,V2= ;
V3= ,V4= 。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是 (填“实验编号”)
(4)已知Fe3+催化H2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
。
【解析】(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O。
恒容密闭容器中,某化学反应2A![]() B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
B+D在四种不同条件下进行,B、D起始浓度为0,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
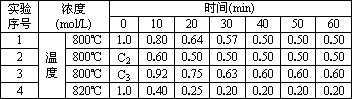
根据上述数据,完成下列填空:
(1)在实验1,反应在前20 min内用B的浓度变化来表示的平均速率为________mol/(L·min).
(2)在实验2,A的初始浓度c2=________mol/L,反应在20分钟内就达到平衡,可推测实验2中还隐含的条件是________.
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1(用同种物质的浓度变化表示),则达到平衡时υ3________υ1(填>、=、<=)且c3=________mol/L.
(4)比较实验4和实验1,可推测该反应是________反应(选填“吸热”、“放热”).
(5)800℃时,反应2A![]() B+D的平衡常数=________,实验2中达到平衡时A的转化率=________.
B+D的平衡常数=________,实验2中达到平衡时A的转化率=________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com