
题目列表(包括答案和解析)
生物体中有许多含过渡金属离子的蛋白,其中有些金属蛋白在一定条件下能够吸收、释放氧气以供机体生命活动之需。这些天然载氧体的结构较复杂。研究发现,某些简单配合物也具有类似的载氧性质,可用作载氧体的模型化合物。研究较多的是钴(II)配合物。制备模型化合物的方法如下:水杨酸(邻羟基苯甲醛)和乙二胺在95%的乙醇溶液中反应,生成黄色晶体人通入氮气,加热,待黄色晶体溶解后,缓慢地加入醋酸钴,生成棕色沉淀。继续加热并搅拌,沉淀全部转变为暗红色B后,冷至室温,撤去氮气,滤出结晶,干燥之B是二聚体,在室温下稳定,不吸收氧气。但B在某些溶剂中可与溶剂L(如DMF或Py等)配位,并迅速吸收氧气形成暗黑色的分子氧加合物C。C在氯仿或苯中有细微气泡放出,并转变为暗红色。载氧试验结果: 360 mg样品B 在 15℃, 102.9kPa及饱和水蒸气压 1.2 kPa下,吸收 O2(设为理想气体) 12.90cm3。
3-1.写出A的化学式。
3-2.计算载氧试验中,Co 与被吸收氧气的物质的量之比。
3-3.画出C的结构示意图。
3-4.写出C在氯仿中的反应方程式。
(12分)
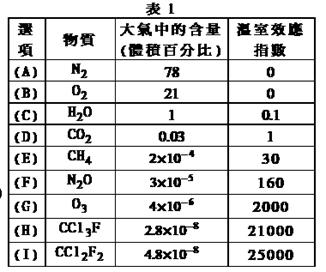
为了比较温室效应气体对目前全球增温现象的影响,科学家通常引用“温室效应指数”,以二氧化碳为相对标准。表1有(A)至(I)共九种气体在大气中的体积百分比及其温室效应指数。
结合表中列出的九种气体,试参与回答下列各题:
(1)下列由极性键形成的非极性分子是 。
A.N2 B.O2 C.H2O D.CO2 E.CH4
(2)下列说法正确的是 。
A.N2O与CO2, CCl3F与CCl2F2互为等电子体
B.CCl2F2无同分异构体,说明其中碳原子采用sp2方式杂化
C.CCl2F2是目前引起温室效应的主要原因
D.H2O沸点是九种物质中最高的,是因为水分子间能形成氢键
(3)在半导体生产或灭火剂的使用中,会向空气逸散气体如:NF3、CHClFCF3、C3F8,它们虽是微量的,有些确是强温室气体,下列推测正确的是 。
A.由价层电子对互斥理论可确定NF3分子呈平面三角形
B.C3F8在CCl4中的溶解度比水中大
C.CHClFCF3存在手性异构
D.电负性:N<O<F
(4)甲烷晶体的晶胞结构如图,下列有关说法正确的 。
A.甲烷在常温下呈气态,说明甲烷晶体属于分子晶体
B.晶体中1个CH4分子有6个紧邻的甲烷分子
C.CH4晶体熔化时需克服共价键
D.可燃冰(8CH4·46H2O)是在低温高压下形成的晶体
(5)水能与多种过渡金属离子形成络合物,已知某紫红色络合物的组成为CoCl3·5NH3·H2O。其水溶液显弱酸性,加入强碱并加热至沸腾有氨放出,同时产生Co2O3沉淀;加AgNO3于该化合物溶液中,有AgCl沉淀生成,过滤后再加AgNO3溶液于滤液中无变化,但加热至沸腾有AgCl沉淀生成,且其质量为第一次沉淀量的二分之一。则该配合物的化学式最可能为 。
A.[CoCl2(NH3)4 ]Cl·NH3·H2O B.[ CoCl(NH3)5]Cl2·H2O
C.[CoCl2(NH3)3(H2O)]Cl·2NH3 D.[ Co(NH3)5(H2O)]Cl3
(6)题(5)中钴离子在基态时核外电子排布式为: 。
 性异构
性异构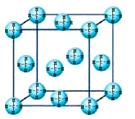
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com