
题目列表(包括答案和解析)
与立方烷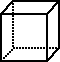 具有相同最简式的一种有机物,其相对分子质量是立方烷的一半,该分子是由
具有相同最简式的一种有机物,其相对分子质量是立方烷的一半,该分子是由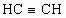 合成的,它是合成某种橡胶的中间体,它也有多种同分异构体.
合成的,它是合成某种橡胶的中间体,它也有多种同分异构体.
(1)它的一种链式结构的同分异构体的结构简式是_________.该同分异构体的分子中,所有的原子是否共面_________,所有的碳原子是否共线___________.
(2)它的另一种同分异构体的每个碳原子均达到饱和,且空间构型中碳与碳之间的夹角都相同,该同分异构体的分子中直接键合的三个碳原子间的夹角是______,请画出它的空间构型_______.
 (1)铁及铁的化合物在生产、生活中有着重要的用途.
(1)铁及铁的化合物在生产、生活中有着重要的用途.(16分)(1)铁及铁的化合物在生产、生活中有着重要的用途。
①、聚合硫酸铁(简称PFS)[Fe (OH)n(SO4)(3-n) / 2 ]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子。则其中铁元素的价态为__________,SO42-的空间构型为 。
②、六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀。CN-中碳原子的杂化方式为__________,写出与CN一互为等电子体的一种离子的化学式_______,其电子式为________。
③三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂。据此推断三氯化铁晶体为__________晶体。
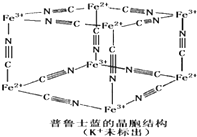
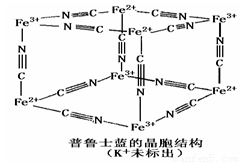
④普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一):n(K+):n(Fe3+):n(Fe2+) = ____________。
(2)水和氨有相似之处,如:H2O+H+=H3O+ 、NH3+H+=NH4+。
①NH4+的键角__________H3O+的键角(填“大于”或“小于”)。
②冰和固态氨的晶胞都不属于分子最密堆积,原因是__________________。
(16分)(1)铁及铁的化合物在生产、生活中有着重要的用途。
①、聚合硫酸铁(简称PFS)[Fe (OH)n(SO4) (3-n) / 2 ]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子。则其中铁元素的价态为__________,SO42-的空间构型为 。
②、六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀。CN-中碳原子的杂化方式为__________,写出与CN一互为等电子体的一种离子的化学式_______,其电子式为________。
③三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂。据此推断三氯化铁晶体为__________晶体。
④普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一) :n(K+):n(Fe3+):n(Fe2+) = ____________。
(2)水和氨有相似之处,如:H2O+H+=H3O+ 、NH3+H+=NH4+。
①NH4+的键角__________H3O+的键角(填“大于”或“小于”)。
②冰和固态氨的晶胞都不属于分子最密堆积,原因是__________________。
(16分)(1)铁及铁的化合物在生产、生活中有着重要的用途。
①、聚合硫酸铁(简称PFS)[Fe (OH)n(SO4) (3-n) / 2 ]m(m是聚合度),常用于在水体中形成絮状物,以吸附重金属离子。则其中铁元素的价态为__________,SO42-的空间构型为 。
②、六氰合铁酸钾K3[Fe(CN)6]可用于检验Fe2+,出现特殊的蓝色沉淀。CN-中碳原子的杂化方式为__________,写出与CN一互为等电子体的一种离子的化学式_______,其电子式为________。
③三氯化铁在常温下为固体,熔点304℃,沸点316℃,300℃以上可升华,易溶于水,也易溶于乙醚,丙酮等有机溶剂。据此推断三氯化铁晶体为__________晶体。
④普鲁士蓝是一种配合物,可用作染料,它的结构单元如右图所示,普鲁士蓝中n(CN一) :n(K+):n(Fe3+):n(Fe2+) = ____________。
(2)水和氨有相似之处,如:H2O+H+=H3O+ 、NH3+H+=NH4+。
①NH4+的键角__________H3O+的键角(填“大于”或“小于”)。
②冰和固态氨的晶胞都不属于分子最密堆积,原因是__________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com