实验方案的设计应明确实验目的,根据实验原理,选择合适的实验仪器,经过合理的实验步骤,采集必要的数据,完成实验并对结果进行分析.实验室有一些氧化铜和铜粉的混合物,欲知道其各组分的含量,设计了如下实验方案.
方案一:
㈠实验目的:测定氧化铜与铜的混合物中氧化铜和铜的质量分数.
㈡实验原理:氧化铜可溶于稀硫酸而铜与稀硫酸不反应.
㈢实验用品
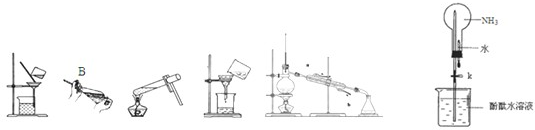
天平,烧杯,玻璃棒,漏斗架,滤纸,干燥器,仪器甲;硫酸(3mol/L),试纸乙,混合物样品.
㈣实验步骤
①用天平称取混合物m
1g混合物倒入烧杯中.
②向烧杯中加入过量的硫酸使氧化铜完全溶解.
③过滤,留取滤渣铜粉.
④将③中所得铜粉洗净后移入干燥器干燥.
⑤称量铜粉的质量为m
2g.
㈤根据所记录的数据计算原混合物中氧化铜的质量分数和铜的质量分数.
方案二:
㈠实验目的:测定氧化铜与铜的混合物中氧化铜和铜的质量分数.
㈡实验原理:铜在加热条件下易被空气中氧气氧化而氧化铜在同样条件下相对稳定.
㈢实验用品
天平,酒精灯,坩埚,坩埚钳,三脚架,泥三角,干燥器;混合物样品.
㈣实验步骤
(1)用天平称坩埚的质量为m
1g,坩埚与混合物样品的总质量为m
2g.
(2)在空气中小心加热样品.
(3)
将加热后的固体置于干燥器中冷却后称量
将加热后的固体置于干燥器中冷却后称量
.
(4)重复步骤②③至坩埚和样品恒重为m
3g.
㈤根据所纪录的数据计算原混合物中氧化铜的质量分数和铜的质量分数.
回答下列问题:
(1)方案一中仪器甲的名称是
普通漏斗
普通漏斗
,试纸乙是
pH试纸
pH试纸
.
(2)方案一中确定所加硫酸已足量的方法是
用玻璃棒蘸取溶解固体所得溶液于pH试纸上,若溶液呈强酸性则硫酸已过量
用玻璃棒蘸取溶解固体所得溶液于pH试纸上,若溶液呈强酸性则硫酸已过量
.
(3)方案一中步骤④若没有用水洗净,则所测铜的质量分数结果
偏高
偏高
(填“偏高”、“偏低”或“无影响”)
(4)方案二中所缺步骤③的内容是
将加热后的固体置于干燥器中冷却后称量
将加热后的固体置于干燥器中冷却后称量
.
(5)方案二中步骤④的目的是
确定固体混合物中的铜氧化完全
确定固体混合物中的铜氧化完全
.