
题目列表(包括答案和解析)
控制反应条件可改变化学反应速率。
(1)使用催化剂是改变化学反应速率的一种方法,例如H2O2在MnO2作用下分解,请写出该反应的化学方程式:_____________________________。
(2)经研究发现Fe3+和Cu2+对H2O2的分解也具有催化作用。
某研究小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验,请将他们的实验方案补充完整:
实验目的:_________________________________-
实验试剂:5%H2O2溶液,0.1mol/LFeCl3溶液,0.1mol/LCuSO4溶液
实验仪器:试管、胶头滴管
实验步骤:取两支试管各加入1mL5%H2O2溶液,分别滴加两滴0.1mol/LFeCl3溶液、0.1mol/LCuSO4溶液。
该小组的同学可通过观察______________________以比较出Cu2+和Fe3+的催化效果。
问题与讨论:有同学提出将FeCl3改为Fe2(SO4)3更合理,你认为他的理由是____________________________________________________。
(3)影响化学反应速率的因素除催化剂外,还有______________(答出一种即可),并举一例生产、生活实例加以说明:__________________________。
控制反应条件可改变化学反应速率。
(1)使用催化剂是改变化学反应速率的一种方法,例如H2O2在MnO2作用下分解,请写出该反应的化学方程式:_____________________________。
(2)经研究发现Fe3+和Cu2+对H2O2的分解也具有催化作用。
某研究小组为比较Fe3+和Cu2+对H2O2分解的催化效果,设计了如下实验,请将他们的实验方案补充完整:
实验目的:_________________________________-
实验试剂:5%H2O2溶液,0.1mol/LFeCl3溶液,0.1mol/LCuSO4溶液
实验仪器:试管、胶头滴管
实验步骤:取两支试管各加入1mL5%H2O2溶液,分别滴加两滴0.1mol/LFeCl3溶液、0.1mol/LCuSO4溶液。
该小组的同学可通过观察______________________以比较出Cu2+和Fe3+的催化效果。
问题与讨论:有同学提出将FeCl3改为Fe2(SO4)3更合理,你认为他的理由是____________________________________________________。
(3)影响化学反应速率的因素除催化剂外,还有______________(答出一种即可),并举一例生产、生活实例加以说明:__________________________。
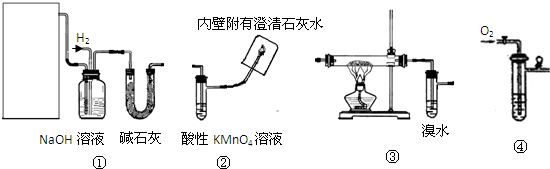
| 催化剂 |
| △ |
| 催化剂 |
| △ |
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
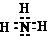
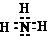
| ||
| ||
 下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
下面是中学化学中常用玻璃仪器组成的实验装置图(根据需要可在其中加入液体或固体).
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com